教你秒懂如何使用慢病毒
病毒包裝是生物醫學研究中的一大利器。通過病毒我們可以高效地讓我們要研究的基因在目標細胞中過表達或者特異性地敲低細胞中的目標基因。科研中用到的病毒主要有慢病毒、腺病毒、腺相關病毒。根據各種病毒不同的特性,不同的課題需要包裝不同的病毒。比如,腺相關病毒更適合進行動物在體研究。腺病毒具有包裝容量大、適合在體研究等有點。
生物醫學科研中使用得最多的是慢病毒,慢病毒具有外源基因容量大、目的基因整合穩定表達、可同時感染分裂和非分裂細胞、轉染效率高的特點,已經廣泛應用于基礎科研、臨床研究中。
1、預實驗的重要性
文獻報道或他人經驗中的MOI(感染復數,毒粒與被感染細胞的數量比值),不僅取決于病毒對細胞本身的親噬性,而且受到不同來源重組病毒滴度測定誤差、使用保存過程損失、具體細胞狀態、傳代次數、細胞密度、具體實驗操作等方面的影響。完全照搬MOI可能并不能達到最佳效果。
傳代細胞系、原代細胞等材料,實際狀態在各個實驗室也會存在一定差異。預實驗的目的是找出能夠達到最高感染效率、同時細胞狀態未受到明顯影響的一個恰當病毒用量。
2、預實驗安排
設置不同MOI值的感染組。可設立5、10、20、50的感染復數梯度,各兩孔,一孔加入終濃度為5 ug/ml的polybrene,另一孔不加。如果只需通過熒光顯微鏡觀察,則使用96孔板即可。如需做Real-time PCR或流式檢測則至少使用24孔板。在6 h、12 h、24h左右觀察總結感染細胞狀態,在72 h左右檢測感染效率及表達水平。如為RNAi需檢測蛋白水平下調可進一步延遲24 h。
如果有文獻報道的MOI值,可使用該值的0.5x、1x、2x、4x進行測試。如使用較難感染的細胞進行實驗,建議設置易感染細胞組如293、Hela、A549等作為陽性對照。
為了便于實驗應用,且培養體系中的實際細胞數量存在計數誤差,用量預實驗的結論可總結為一定培養規模(如96孔板、6孔板)下、一定細胞密度時(如60%)、原始毒液加入體積(如5 μl)。當需要放大或縮小實驗體系時,可根據培養面積(對應細胞數)按比例換算得出病毒用量。

3、感染方法(以24孔板為例)
第一天,準備感染細胞。在24孔板中接種目的細胞約5x104/孔,每孔培養基體積0.5 ml。目的細胞的狀態對于感染及表達非常重要。第二天,凍存待用的病毒于冰上融化,如需稀釋毒液可以用培養基進行稀釋(基礎培養基或完全培養基均可,血清、雙抗不影響病毒感染)。觀察前一天準備的細胞,狀態良好,進行病毒感染時細胞的匯合度約為50-60%左右。
按滴度計算毒液所需的用量。如原始滴度為1x108 TU /ml,每孔擬病毒用量為0.5x106 TU,則需要使用原液5 ul。將所需用量的毒液加入完全培養基(500ul)、混勻,吸除孔板中原培養基,加入混合毒液的培養基。放于二氧化碳培養箱(37℃、5%CO2)孵育培養。根據細胞狀態更換培養基,如狀態良好可在12-16h更換培養基,病毒孵育時間不短于4 h。需要使用polybrene時,在孵育培養基中先于毒液加入例如5 μg/ml終濃度的polybrene混勻。
按照正常培養基條件繼續培養48-72 h后可檢測感染效率。在倒置熒光顯微鏡觀察熒光,估計慢病毒感染目的細胞的效率。如載體未攜帶標記基因的,可以通過Real-time PCR檢測目的基因表達。慢病毒表達產物在72-96 h左右接近高峰,如細胞生長代謝緩慢需適當延長時間,生長旺盛的細胞在48 h即可觀察基因表達。
4、實驗參考信息
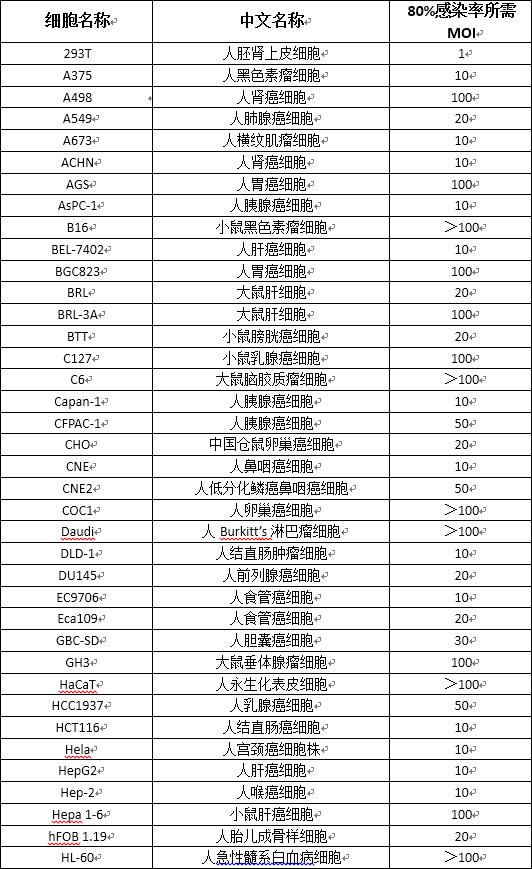
(1) 常用細胞系參考MOI值
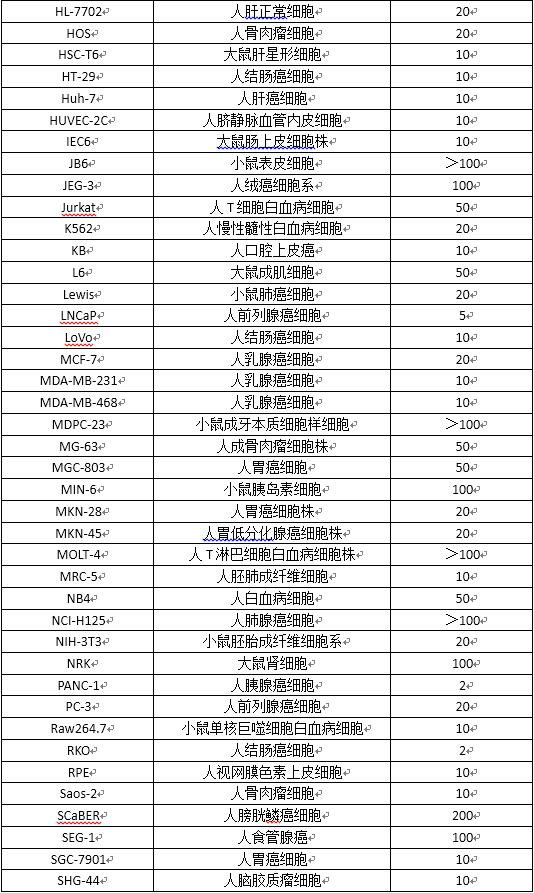
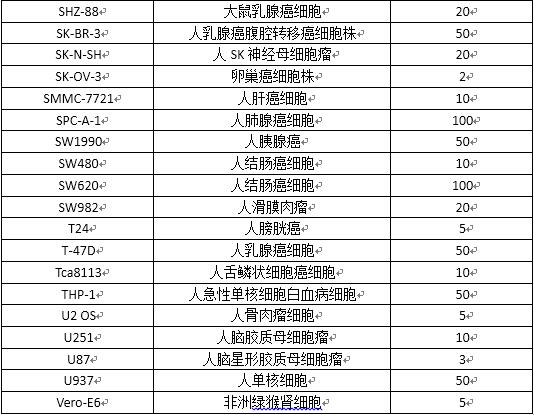
(2)常用培養器皿使用參數