歸納總結WB實驗過程中的各種問題和解決方法
前言
Western Blot 蛋白質免疫印跡法(簡稱:WB),是基于蛋白質SDS-PAGE電泳分離和特異性抗體識別蛋白的特性,通過顯色達到檢測目標蛋白的一種技術。Western blot 近年來發展迅速,成為了蛋白研究方向的一種主要技術,但由于其實驗步驟和關鍵點多,耗時長,每個步驟可能都會影響最終結果,所以實驗中也會遇到各種問題,導致最終的結果“五花八門”,也讓眾多“新手”抓狂!
關于WB實驗的常見問題,有過不少網絡文獻做過總結和分析,本文將結合前人的經驗對常見的問題進行歸納,給出解決方法,建議收藏!
Western Blot 實驗流程
首先讓我們溫故而知新,回顧一下WB的實驗流程(如圖一所示)
Western Blot免疫印跡雜交試驗步驟多,包含多個影響實驗結果因素,如 SDS-PAGE 膠濃度、轉膜緩沖液、封閉液、一抗抗體及其特異性,二抗孵育及漂洗等。
常見問題
本文將現象總結歸納為以下五類,分析問題的原因,并為大家提供可參考的解決方法。
1. 膜上無信號或無目標條帶
2. 目標條帶信號弱
WB結果中可能出現有目標蛋白條帶,但是目標條帶在膜上顏色較淺,原因和解決建議如下:
3. 圖像高背景
3.1 均一性的高背景
3.2 非均一性高背景
4. 非特異性條帶多
5. 條帶形狀異常
5.1 啞鈴狀條帶 該現象可能有兩個原因導致。一是由于配置膠有問題,膠凝固后不均一,可通過重新配置膠,確保膠質量無問題。二是樣品可能含有過多雜質,我們在樣品使用前對其進行離心,以去除過多雜質。
該現象可能有兩個原因導致。一是由于配置膠有問題,膠凝固后不均一,可通過重新配置膠,確保膠質量無問題。二是樣品可能含有過多雜質,我們在樣品使用前對其進行離心,以去除過多雜質。
5.2 條帶發白 該現象可能原因是一抗濃度過高,二抗上HRP催化活力太強,同時顯色底物處于臨界點,反應時間不長,將周圍底物催化完,形成了空白。可降低一抗和二抗濃度,或者更換底物。
該現象可能原因是一抗濃度過高,二抗上HRP催化活力太強,同時顯色底物處于臨界點,反應時間不長,將周圍底物催化完,形成了空白。可降低一抗和二抗濃度,或者更換底物。
5.3 條帶拖尾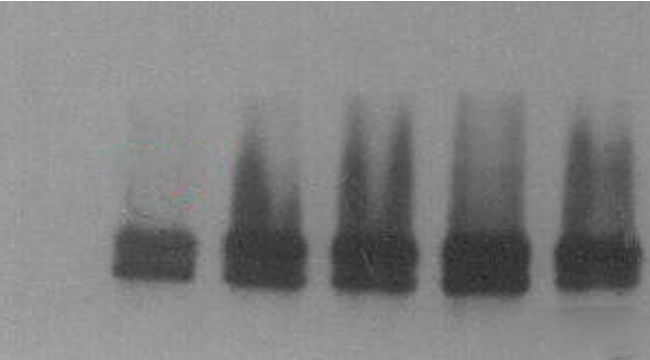 該現象主要原因是蛋白量太大,或一抗濃度和時間太長,可根據情況調整蛋白量,同時一抗濃度和時間也可以縮短。
該現象主要原因是蛋白量太大,或一抗濃度和時間太長,可根據情況調整蛋白量,同時一抗濃度和時間也可以縮短。
5.4 條帶相連 出現該現象的原因可能是上樣量太大或是制膠問題,分離膠和濃縮膠之間有間隙,樣品竄孔。可通過減少上樣量和提高配膠質量來避免該問題。
出現該現象的原因可能是上樣量太大或是制膠問題,分離膠和濃縮膠之間有間隙,樣品竄孔。可通過減少上樣量和提高配膠質量來避免該問題。
5.5 條帶呈現微笑狀 電泳條帶或整體出現 “︶ ”形狀,可能原因主要為:電泳速度過快,可通過減少電壓等減慢電泳速度;或是電泳溫度過高,使得膠變形,可在冷室或者冰浴中進行電泳或者改變電泳pH。
電泳條帶或整體出現 “︶ ”形狀,可能原因主要為:電泳速度過快,可通過減少電壓等減慢電泳速度;或是電泳溫度過高,使得膠變形,可在冷室或者冰浴中進行電泳或者改變電泳pH。
5.6 條帶中出現邊緣規則的白圈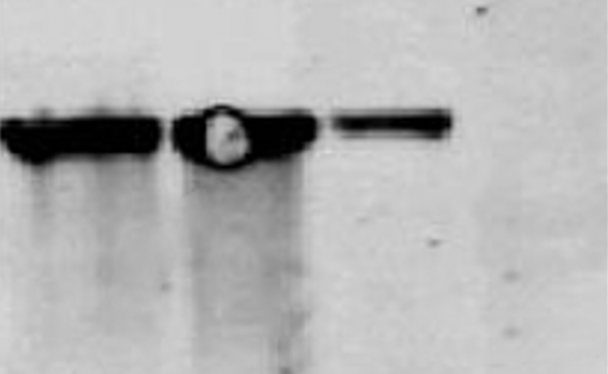 該現象很大可能是電轉中膜和膠之間存在氣泡,建議在轉膜前去掉膜和膠之間的氣泡。
該現象很大可能是電轉中膜和膠之間存在氣泡,建議在轉膜前去掉膜和膠之間的氣泡。
總結一下
Western blot 技術目前是蛋白研究中最常用的方法之一,但也因為其步驟繁雜讓結果變幻莫測。但只要規范實驗流程,選用適合的試劑耗材和穩定的成像系統,相信大家都會做出“美麗”的條帶。
申花科技的產品包括:化學發光成像系統、凝膠成像系統及與之相配套的試劑。目前產品免費試用持續進行中,歡迎關注我們的公眾號,點擊最右側“產品試用”按鈕申請試用。
Western Blot 蛋白質免疫印跡法(簡稱:WB),是基于蛋白質SDS-PAGE電泳分離和特異性抗體識別蛋白的特性,通過顯色達到檢測目標蛋白的一種技術。Western blot 近年來發展迅速,成為了蛋白研究方向的一種主要技術,但由于其實驗步驟和關鍵點多,耗時長,每個步驟可能都會影響最終結果,所以實驗中也會遇到各種問題,導致最終的結果“五花八門”,也讓眾多“新手”抓狂!
關于WB實驗的常見問題,有過不少網絡文獻做過總結和分析,本文將結合前人的經驗對常見的問題進行歸納,給出解決方法,建議收藏!
Western Blot 實驗流程
首先讓我們溫故而知新,回顧一下WB的實驗流程(如圖一所示)

(圖一:Western Blot 實驗流程)
Western Blot免疫印跡雜交試驗步驟多,包含多個影響實驗結果因素,如 SDS-PAGE 膠濃度、轉膜緩沖液、封閉液、一抗抗體及其特異性,二抗孵育及漂洗等。
常見問題
本文將現象總結歸納為以下五類,分析問題的原因,并為大家提供可參考的解決方法。
1. 膜上無信號或無目標條帶

(實驗結果無目標條帶,因抗體選用不當)
| 問題 | 可能的原因 | 建議 |
| 操作問題 | 洗膜過度 | 洗膜時間不宜過長,加入的去垢劑不宜過強或過多,減少洗膜次數,洗膜時間和溫度 |
| 蛋白未轉到膜上 | 轉膜結束后,用總蛋白染色劑染膠來確定轉膜效率;轉膜過程中膠與膜完全接觸;轉印夾層排布正確;按照膜的制造商的使用說明潤濕膜;轉印部件在電印跡過程中未過熱;使用正對照和/或分子量 Marker;可以用麗春紅染膜并結合染膠(考馬斯亮藍)后確定條帶是否轉至膜上或轉移過頭;適當調整轉膜的時間和電流優化轉印時間和電流。 | |
| 蛋白未完全結合到膜上 | 低分子量的抗原可能會穿過轉印膜,需使用小孔徑的膜進行。 | |
| 過度封閉 | 減少封閉時間,試用不同的封閉液 | |
| 底物孵育時間太短 | 延長底物孵育的時間。 | |
| 抗體問題 | 一抗、二抗不匹配 | 選擇與一抗相匹配的二抗類型,二抗需和一抗宿主的物種相同。可通過設置內參可以驗證二級檢測系統的有效性。 |
| 一抗失效 | 使用有效期內的抗體,分裝保存,避免反復凍融取用,工作液現用現配。 | |
| 結合目標蛋白的抗體不足 | 降低一抗稀釋度;使用效價高的一抗;延長抗體孵育時間;膜充分浸潤在液體中。 | |
| 一抗或/二抗濃度低 | 增加抗體濃度; | |
| 一抗或/二抗濃度太高 | 使用太多一抗或二抗可能導致底物迅速耗竭,呈現出很弱的信號 | |
| 抗原問題 | 一抗不識別目標蛋白 | 參照數據庫對比抗原序列和蛋白序列,選擇合適的一抗 |
| 抗原不足或降解 | 每條泳道上樣量不低于 20~30 ug, 使用蛋白酶抑制劑并設置陽性對照。 | |
| 封閉底物可能含有蛋白水解酶活性(如明膠) | ||
| 緩沖液問題 | 封閉液與一抗或二抗有交叉反應 | 更換適合的封閉液 |
| 緩沖液中含有疊氮鈉 | 疊氮鈉是一種 HRP 的抑制劑,緩沖液不能使用疊氮鈉作為防腐劑。 | |
| ECL發光液失活或靈敏度不夠 | 更換發光液,選擇超敏發光液 | |
| 曝光時間不足 | 延長曝光時間 |
2. 目標條帶信號弱

| 問題 | 可能的原因 | 建議 |
| 操作問題 | 轉膜不充分 | 規范轉膜的操作;優化電轉條件;可將兩張膜疊加在一起,防止轉膜過度,或使用小孔徑膜 |
| 洗膜過度 | 洗膜時間不宜過長,加入的去垢劑不宜過強或過多,減少洗膜次數,洗膜時間和溫度 | |
| 封閉過度 | 減少封閉時間,試用不同的封閉液 | |
| 曝光時間過短 | 延長曝光時間,如使用化學發光成像系統,可調整顯示灰度值 | |
| 抗體染色不充分 | 延長孵育時間或增加抗體濃度 | |
| 抗體問題 | 抗體濃度低 | 增加抗體濃度 |
| 抗體和抗原親和力不足 | 增加抗體濃度 | |
| 抗體活性不足 | 使用有效期內的抗體,分裝保存,避免反復凍融取用,工作液現用現配。 | |
| 抗原問題 | 抗原量不足 | 增加上樣量 |
| 緩沖液問題 | 緩沖液中含有疊氮鈉 | 疊氮鈉是一種 HRP 的抑制劑,緩沖液不能使用疊氮鈉作為防腐劑。 |
3. 圖像高背景
3.1 均一性的高背景

| 問題 | 可能原因 | 建議 |
| 操作問題 | 封閉溫度過高,封閉不完全 | 封閉液的選擇與優化;使用5%脫脂奶粉封閉;優化封閉時間和溫度 |
| 膜的問題 | 防止膜過程中干燥;換用NC膜進行實驗;使用干凈鑷子并戴手套操作 | |
| 孵育中洗膜不充分 | 適當增加洗膜時間和次數;確保在充分震蕩的條件下孵育膜,并且抗體充分覆蓋膜表面 | |
| 曝光過度 | 縮短曝光時間,或等待數分鐘后使用成像儀拍攝 | |
| 抗體問題 | 一抗,二抗濃度較高 | 提高一抗,二抗稀釋度,優化稀釋條件 |
| 一抗,二抗和封閉液結合 | 更換封閉液;更換二抗或降低二抗濃度 | |
| 儲存時間較長或儲存條件不當導致抗體失活 | 選擇新的抗體 | |
| 抗原問題 | 緩沖液中去污劑不夠 | 增加TBST中Tween 20的濃度 |
| 緩沖液問題 | 轉膜液,封閉液等不新鮮或被污染 | 現用現配 |
3.2 非均一性高背景

| 問題 | 可能的原因 | 建議 |
| 操作相關 | 封閉溫度過高,封閉不完全 | 封閉液的選擇與優化;增加封閉液中蛋白濃度;優化封閉時間和溫度 |
| 膜沒有正確潤濕,也可能干過 | 使用干凈鑷子并戴手套操作;使用足夠液體,膜始終保持濕潤;孵育時使用脫色搖床;避免膜重疊,相互覆蓋 | |
| 抗體問題 | 抗體濃度太高 | 提高一抗,二抗稀釋度,優化稀釋條件 |
| 二抗聚集 | 使用前過濾二抗或者更換二抗 | |
| 封閉劑中有聚集體 | 使用前過濾封閉劑或者更換 | |
| 一抗,二抗和封閉液結合 | 更換封閉液, 或更換二抗或降低二抗濃度 | |
| 緩沖液問題 | 儀器或用具被污染 | 保證儀器和用具干凈;確保膜上無殘留膠 |
| 轉膜液,封閉液等不新鮮或被污染 | 使用干凈、新鮮的轉膜液,封閉液。建議現用現配 |
4. 非特異性條帶多

| 可能原因 | 建議 |
| 抗體與蛋白非特異性結合 | 更換抗體 |
| 抗體濃度太高 | 降低上樣量;提高一抗稀釋度。 |
| 抗體未純化 | 使用單克隆或親和層析純化后的抗體,減少非特異條帶 |
| 轉膜強度太強,導致雜帶太強 | 降低轉膜強度(時間和電流),使目標蛋白上方的蛋白少轉移到膜上。 |
| 封閉不完全 | 增加封閉液中蛋白濃度 |
| 細胞傳代次數過多,導致其蛋白表達模式分化 | 使用原代或者傳代少的細胞株,和現在的細胞株一起做參照 |
| 新蛋白或同族蛋白分享同種表位的不同剪接方式 | 查其文獻報導,使用說明書報導的細胞株或組織 |
5. 條帶形狀異常
5.1 啞鈴狀條帶

5.2 條帶發白

5.3 條帶拖尾

5.4 條帶相連

5.5 條帶呈現微笑狀

5.6 條帶中出現邊緣規則的白圈

總結一下
Western blot 技術目前是蛋白研究中最常用的方法之一,但也因為其步驟繁雜讓結果變幻莫測。但只要規范實驗流程,選用適合的試劑耗材和穩定的成像系統,相信大家都會做出“美麗”的條帶。
申花科技的產品包括:化學發光成像系統、凝膠成像系統及與之相配套的試劑。目前產品免費試用持續進行中,歡迎關注我們的公眾號,點擊最右側“產品試用”按鈕申請試用。

Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





