美國食品藥品監督管理局FDA與我國藥品審評中心CDE審評流程的差別
創新是醫藥行業發展的引擎,在為人類創造更好的生活水平的同時也成為新的經濟發展增長點。在2010年至2020年的十年間,我國有101種創新藥遞交了申請,其中58種成功獲得批準,整體呈現快速發展的勢頭。2015年8月,中國國務院發布《關于改革藥品醫療器械審評審批程序的意見》,吹響了我國醫藥監管改革的號角,努力為創新藥的發展創造一個良好的監管環境。但是放眼國際我們仍然與美國、歐盟等地區存在一定差距,師夷長技以制夷,現階段我們依然可以從先進地區尋求改善的途徑。美國長居創新藥研發和上市的龍頭地位,因此對比美國食品藥品監督管理局FDA與我國藥品審評中心CDE審評流程的差別,一定會對我們有所啟示。
01 FDA新藥申報

圖1:FDA新藥審評流程
從這個審核流程我們不難看出FDA為了確保藥物的臨床試驗結果具有科學價值和可靠性,對于臨床試驗設計和數據質量有嚴格要求。FDA對于生物新藥的審評有幾個特點,首先,FDA提供了加速審評通道,如優先審評、快速跟蹤、加速批準等,以加速審評和上市進程,滿足患者需求。其次,FDA強調科學原則和創新,鼓勵采用新的科技、方法和策略進行藥物研發,并支持藥物研發的多樣性和靈活性。第三,FDA注重患者安全和效益,要求藥企提供充分的臨床試驗數據來支持藥物的安全性和有效性。此外,FDA鼓勵藥物個性化研發,支持藥物在特定亞群體中的療效評估,并為藥物在特定人群中的應用提供指導和批準。
02 CDE新藥評審流程

圖2:CDE新藥審評流程
CDE對于生物新藥的審評則更強調臨床試驗數據的有效性和科學性、注重藥物在中國人群中的研究、對藥物的質量、效能、安全性進行全面評估,以及審查藥物的臨床應用和推廣。我們可以看出CDE的審核過程需要耗費較長時間,藥企在申報時需要提交大量的數據和文檔,這需要耗費較長的時間和精力來滿足CDE的要求。針對這個問題,目前CDE在提高審評效率、保障藥物質量和安全等方面持續改進和提升,以促進生物新藥的審評和上市。藥企在申報生物新藥時需積極配合CDE的審評要求,充分了解中國藥物審評的特點,以確保符合國內要求,推動藥物的審評和上市進程。
03 中美雙報法規差異及策略
目前不少大型跨國藥企為了加快藥品上市速度及保證中美上市產品質量的一致性,實行同時或分階段進行中美兩國申報。中美雙報就法律法規還是會有一些差別,主要體現在以下六個方面。
1、原材料的控制
采用適用的原材料是cGMP/GMP的重要控制要素之一,也是生產生物制品產品及IND申報的主要挑戰之一。比如IND申報中常出現使用研究級別的原材料,如細胞因子和生長因子等,以及人和動物源性材料(如胎牛血清)的使用。對于動物源原材料的控制,需進行外源因子檢測。另外,對于生物來源的試劑,包括人、牛和豬源,可參考FDA的指南:“Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Diseasel ndications”。若生產試劑用到了牛源物料,應加以鑒別并記錄牛源物料的來源和合格性,并提供用于生產和建立符合9CFR113.53的COA和COO。
生物制品IND申報主要包括原料、輔料、藥包材。CDE要求滿足Ch.P要求,如輔料若藥典無收錄,可以選用符合USP、EP標準的輔料。FDA對主要原料、輔料、藥包材的檢測不一定都參照USP標準,但無菌、內毒素等安全性指標需參照USP,另外DP所用輔料推薦參照USP標準。中美雙報用的輔料應建立內控標準,滿足中美要求。其它原料無差異,要求有供應商審計系統(如培養基需出具無動物源聲明)。
 圖3:中美雙報原材料法規要求及IND策略
圖3:中美雙報原材料法規要求及IND策略
2、細胞庫
就生物制品IND要求需提供對細胞庫的歷史及源材料的詳細描述,應包括細胞來源的信息(包括來源物種);細胞庫是如何建立的(如從單菌落分離物或通過限度稀釋產生的);當細胞經過基因改造(如提供病毒蛋白以刺激病毒復制或包裝)時,應提供用于基因改造的描述,包括材料(如質粒、病毒,基因編輯元件)的質量信息。用于生產病毒載體的細胞基質的材料應充分表征,以確保最終基因治療產品的純度及安全性。
生物制品IND申報中CDE要求建立GMP兩級庫,且檢測符合Ch.P.的要求,需檢測MCB、WCB及EOPC,常規檢測機構為中檢院。FDA的要求基本相同于CDE,對于一些特殊生物制品也可以只建立MCB,Phasel的樣品允許用MCB生產。對于計劃中美雙報的生物制品細胞庫檢測可直接找國外檢測機構檢測,CDE接受國外檢測機構對細胞庫的檢測數據。

圖4:中美雙報細胞庫法規要求及IND策略
3、申報批次
CDE要求IND需生產1批次毒理批及3批次IND注冊批次,或者毒理樣品直接從3批次IND批次選擇一批。FDA要求IND一般需生產1批毒理批及1批GMP批次,毒理批工藝要有代表性,與IND批工藝一致。原液、成品考察穩定性考察時間需覆蓋臨床試驗開展時間,規模自行設計,能夠滿足phasel樣品需求及留樣研究需求。

圖5:中美雙報批次要求及IND策略
4、廠房
對于廠房設施的要求,美國cGMP簡單明了、邏輯清晰,以防止生產污染為中心,對廠房的設置、照明、通風、管件、污水和廢料的處理、廠房設施的維護等都作出了具體要求。我國GMP雖然本質要求與美國相同,但未像美國cGMP一樣給出具體要求,其中缺乏對于廢棄物排放和廠房維修的要求。我國GMP規范有9條內容是對潔凈區、室的具體要求,但對于非潔凈區廠房的要求稍顯偏少。對于設備的要求,中美GMP近似。不同之處是,美國對于設備清潔保養程序規定了詳細的最低要求,并且由于美國藥品生產的自動化水平較我國高,其cGMP規范內容多了關于自動化電子設備的要求。另外,出于對注射用藥品生產的重視,cGMP對可能用到的過濾器也作出了嚴格要求。
5、現場核查
就FDA的生物制品批準前檢查(PLI)和CDE生物制品注冊生產現場檢查的檢查依據、檢查程序、檢查內容及檢查組人員組成等方面進行對比,兩機構在檢查依據、檢查內容和檢查組人員組成均有共同之處,詳見下表:

圖6:生物制品中美現場核查模式對比
另外CDE的注冊生產現場檢查以藥品GMP作為檢查的依據,但目前執行的判定標準來自于《藥品注冊現場核查管理規定》中《藥品注冊現場核查要點及判定原則》,《原則》僅將真實性、一致性作為檢查通過與否的標準。而美國FDA的PAI把藥品GMP作為重要依據,如發現GMP嚴重缺陷,就會影響產品的合規性,直接作為判定結果的依據,在源頭上為產品的持續合規打下了基礎。
6、藥學模塊及申報流程
FDA要求所有的IND(包括基因治療產品)描述藥物DS(Drug substance)和DP(Drug product)的CMC信息。IND中提交的CMC信息量取決于研究階段和臨床研究的范圍。在開發的整個階段,CMC審查的重點是產品安全和生產控制。隨著臨床研究的進行、對產品深入理解及制造經驗的積累,申辦方可能需要對先前提交的信息進行修改和補充。需在CTD的模塊3中提交CMC信息。

圖7:中美雙報藥學模塊對比
另外中美IND申報流程也存在一定的差異,美國申報流程自IND受理之日起30日內獲取審評結果,在國內CDE自IND受理之日起60日內通過藥品評審中心網站通知申請人審批結果,逾期未通知視為同意,申請人可按照提交的方案開展藥物臨床實驗。
04 中國新藥申報
目前對于中國生物藥企業來說有幾點啟示,首先,在申報階段需要充分準備臨床試驗數據,并確保數據的合規性和可靠性,以滿足CDE的審評要求。其次,在評審階段,需要與CDE專家充分溝通,了解他們對于臨床試驗數據和藥物生產工藝的關注點,并做好相應準備。同時,對于藥物生產工藝和質量控制,藥企需要在國內生產環節嚴格遵循CDE的要求,確保藥物在國內生產時符合審評要求。此外,對于國際多中心臨床試驗數據的收集和管理,藥企也需要在全球范圍內進行合規操作,以滿足FDA的審評要求。在更大的格局層面,中國生物藥企還應注重跨國合作和國際化戰略,積極參與全球臨床試驗,提高藥物的全球數據支持,以滿足FDA對于多中心試驗數據的要求,加強與FDA的溝通和合作,了解其審評要求和技術指南,并在申請提交、初步評估和審查階段積極配合,提供充分的數據和信息,以促進審評流程的順利進行。
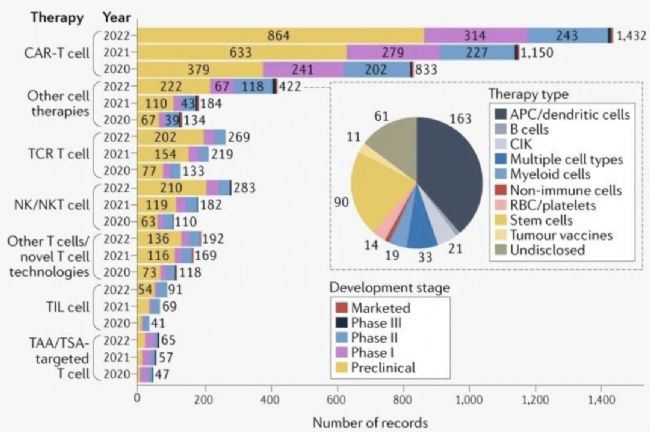
圖8:免疫治療管線
全球CGT行業市場規模自2016年開始飛速增長。2016年至2021年,全球CGT市場從0.5億美元增長到27.8億美元,復合年增長率為153%。我國的CGT產業也在飛速發展的階段,政策方面,官方不斷發布相關監管政策及指導原則,按照藥品理念進行細胞產品開發的路徑也逐漸完善。這說明作為一個較新的領域,細胞基因藥品注冊申報的合規性依然是行業內關注的焦點。對于我國深耕于細胞基因藥物的企業來說,需要貫徹全流程管理的理念進行產品開發,將注冊和項目管理工作融入到開發的各個環節,這樣可以在最大程度上加快相關藥物的研發和上市進程。在生產方面基因細胞治療產品種類多樣,不同的產品具有不同的特性,同時生產工藝的復雜,這些都對藥物的生產和質量控制提出了非常高的要求。
未來隨著中國生物醫藥產業的快速發展和創新藥物研發的不斷推進,CDE對于生物新藥的審評流程有望進一步優化和加速,我國生物藥企在申報新藥時就會節省大量的時間和金錢成本。對于生物藥企,應該密切關注CDE和其他監管機構的政策和法規變化,提前做好準備,不斷提升新藥研發的質量和效率,以滿足市場需求,促進中國生物醫藥產業的蓬勃發展。
說明:本文僅用于傳播知識、普及科學,如有版權等問題,請隨時聯系我們。





