精密氧氣控制系統在用于類器官培養的應用
類 器 官 簡 介
類器官 (Organoid)是在體外,經過3D培養,能夠在體外模擬正常(或疾病)狀態下體內器官(或組織)的三維結構和生理功能。通俗點講,類器官是三維細胞培養物,將干細胞培養于基質膠中,在化學小分子抑制劑/激活劑、細胞因子、培養基添加劑等物質作用下經過培養得到的相應器官類似的組織結構。
類器官擁有自我更新能力,能維持來源組織的生理結構和功能,享有“培養皿中的微器官”之稱。利用干細胞的自我更新、分化能力以及自我組織能力,類器官可冷凍保存用作生物庫,也能無限擴增。類器官高度復雜,相對于2D細胞,更接近于體內狀態。
最近的研究表明,類器官可以用來模擬器官發育和疾病,在基礎研究、藥物發現和再生醫學中有著廣泛的應用。研究人員現在開始從其他領域(如生物工程)獲得靈感,以產生與生理更相關、更適合于現實應用的類器官。在這里我們主要描述類器官在基礎生物學、疾病模型和再生醫學領域的現有和新興應用。
01
類器官的主要應用

圖1 類器官的主要應用
1.類器官作為發育、平衡和再生的模型
類器官在體外重現了器官生物學的一些原理,并提供了簡化且易于獲得的“最小系統”,用于識別不同組織成分對復雜形態發生過程的相對貢獻(圖1a)。
2. 建立疾病損傷模型
類器官誘導的特定組織或器官,可用于特定疾病模型的研究。與傳統的單一細胞類型的細胞培養物相比,類器官培養物用于疾病建模的一個明顯優勢是它們能夠在器官水平上模擬病變(圖1b)。
此外,來自人類ASCs或誘導PSCs(iPSCs)的類器官可以作為人類疾病的模型,再現與轉化研究有關的特定人類特征。目前已經開發了多種基于類器官的疾病模型,再現了遺傳性疾病[1-4]、宿主-病原體相互作用[5-8]或癌癥[9-11],并提供了類器官可以再現某些著名病理特征的原理證明(圖1b)。
3. 藥物篩選
來源于干細胞的類器官能夠用于藥物反應的離體測試,為藥篩提供理論支持。類器官可以模擬人類病理過程為藥物測試和篩選應用的可行性研究提供了新途徑(圖1c)。
4. 藥物毒性和功效測試
利用類器官來驗證新藥在特定器官或組織的藥代毒性,為新藥研發提供數據支持。在個性化醫療中,患者特異性類器官可以幫助為每個患者確定最佳藥物。
5. 再生醫學
干細胞來源的類器官,能夠修復或替代受損或病變的組織以恢復正常的組織功能,在細胞療法上具有廣泛的應用價值,包括用于其他神經退行性疾病、糖尿病、心血管疾病、視網膜病變和脊柱損傷等。類器官正在成為可移植組織和功能細胞類型的潛在來源,用于再生醫學細胞治療(圖1e)。
另外,類器官用于再生醫學可以與體外基因矯正策略相結合,從而能夠自體替換受遺傳疾病影響的組織。在一項原理驗證研究中,CRISPR-Cas9介導的基因編輯用于糾正患者來源的ISCs中導致CF的最常見的CFTR突變,即508位苯丙氨酸的缺失,然后用于產生功能性類器官[12](圖1e)。
類器官的類型非常豐富,主要包括腸道(小腸/結腸)、胃、肝臟、心臟、肺、前列腺、胰腺、腎臟、乳腺、腦類、視網膜以及內耳等。根據類器官類型的不同,其對于生長環境比如氣體環境O2、CO2 濃度的要求會有所不同。以下是使用BioSpherix Xvivo System 培養類器官的具體實例。
02
應用實例1
題目:Distinct Vulnerability and Resilience of Human Neuroprogenitor Subtypes in Cerebral Organoid Model of Prenatal Hypoxic Injury [13]
產前缺氧性損傷(Hypoxic Injury HI)是導致神經系統殘疾的主要原因。在人類大腦早期發育過程中,缺氧對祖細胞穩態和發育進程的即時和長期影響尚不清楚。在這篇研究中使用人大腦類器官復制了一個瞬態HI模型。
D0表示人胚胎干細胞(human embryonic stem cells, hESCs)分化的開始日,D14表示類器官轉移到軌道振蕩器上培養的時間。在D28,類器官在缺氧室(BioSpherix, Xvivo System)中接受3%O2處理24小時,然后切換回常氧條件(21%O2,5%CO2),直到分析。
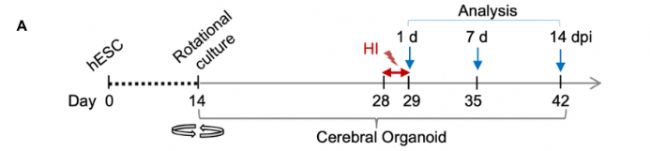
圖2 具有hESC衍生的腦類器官的短暫性缺氧損傷(HI)模型的示意圖。

圖3 人類大腦類器官的短暫缺氧模型
研究結果證明,短暫缺氧可誘導大腦類器官的DNA立即損傷和細胞凋亡延長,橈骨外神經膠質細胞(outer radial glia, oRG)是靈長類動物中更為突出的祖細胞群體,分化的神經母細胞/未成熟神經元損失更大。相反,心室區的神經干細胞對HI表現出相對的彈性,并表現出有利于對稱分裂的切割平面角的偏移,從而提供了補充干細胞庫的機制。此外,我們定義了對HI特別敏感的脆弱窗口和神經分化階段。了解產前HI對人類神經祖細胞亞型在早期皮質發生過程中的存活和有絲分裂行為的細胞類型特異性和階段依賴性影響,有助于闡明神經發育障礙的病因,并提供一個治療起點,在關鍵時間段保護脆弱人群。
應用實例2
題目:Automating iPSC generation to enable autologous photoreceptor cell replacement therapy [14]
遺傳性視網膜變性是發達國家無法治愈的視力損失的主要原因。雖然自體多能干細胞(pluripotent stem cells,iPSC)介導的光感受器細胞替代在理論上是可能的,但由于缺乏高通量平行生產病人特定療法的商業化技術阻礙了臨床轉化。
在這項研究中使用Cell X精密機器人細胞培養平臺來實現臨床級病人特定iPSCs的平行生產。Cell X被安置在符合ISO 5級cGMP標準的封閉式無菌活細胞工作站(BioSpherix, Xvivo System)內(O2濃度在20% -10% -20%變化),在這里進行從成纖維細胞培養到iPSC生成、克隆擴增和視網膜分化的所有程序。

圖4 用于從原代真皮成纖維細胞自動生成iPSC的Cell X機器人平臺。

圖5 在Cell X平臺上產生的iPSCs的視網膜分化。
研究結果表明,使用Cell X平臺生成的患者iPSCs通過評分卡分析被確定為多能性,并通過核型確定為基因穩定。通過免疫染色和共聚焦顯微鏡確定,使用Cell X平臺產生的iPSCs產生了視網膜器官,與人工產生的iPSCs產生的器官沒有區別。此外,在分化后120天,單細胞RNA測序分析顯示,使用Cell X平臺產生的細胞與在單獨實驗室手工條件下產生的細胞相當。總之,該團隊成功開發了一個機器人iPSC生成平臺和標準操作程序,用于生產高質量的光感受器前體細胞,與目前的良好生產規范相兼容。這個系統將使臨床級的iPSCs生產能夠用于自體視網膜細胞替代。
產品
介紹
Xvivo System活細胞工作站旨在超越人們的普通需求,并專門解決細胞(例如:類器官)高級需求的系統,給細胞(例如:類器官)還原真實的生理/病理環境,助力每一位使用的科研先鋒取得更可靠的成果。

圖6 兩篇文章中低氧實驗使用Biospherix Xvivo活細胞工作站
產品特點
· 全密閉無干擾系統,內部潔凈級別達到ISO5
· 高效清潔HEPA系統,每小時不低于30次換風,流速不低于2.8立方米/分鐘。
· 雙模式無菌環境,雙區控溫,培養區與操作區互不干擾,創造適合的細胞生長環境, 讓細胞長得更好,研究結果更具有說服力。
· O2(0.1-99.9%,精度0.1%),CO2(0.1-20%,精度0.1%)探頭置于chamber內,精確測量,所測即所得。
參考文獻:
[1] Lancaster, M. A. et al. Cerebral organoids model human brain development and microcephaly. Nature 501, 373–379 (2013).
This pioneering work reports the derivation of human cerebral organoids featuring coexisting, discrete brain regions. This work is also among the first to use an organoid to model a pathological condition.
[2] Dekkers, J. F . et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nat. Med.19, 939–945 (2013).
This article provides one of the first examples of the development of an organoid-based functional assay for drug discovery and/or screening.
[3] Huch, M. et al. Long-term culture of genome-stable bipotent stem cells from adult human liver. Cell 160, 299–312 (2015).
[4] Xia, Y . et al. Directed differentiation of human pluripotent cells to ureteric bud kidney progenitor-like cells. Nat. Cell Biol. 15, 1507–1515 (2013).
[5] McCracken, K. W. et al. Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature 516, 400–404 (2014).
[6] Bartfeld, S. et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology 148, 126–136.e6 (2015).
[7] Xia, Y . et al. Directed differentiation of human pluripotent cells to ureteric bud kidney progenitor-like cells. Nat. Cell Biol. 15, 1507–1515 (2013).
[8] Zomer-van Ommen, D. D. et al. Functional characterization of cholera toxin inhibitors using human intestinal organoids. J. Med. Chem. 59, 6968–6972 (2016).
[9] Drost, J. et al. Organoid culture systems for prostate epithelial and cancer tissue. Nat. Protoc. 11, 347–358 (2016).
[10] Boj, S. F . et al. Organoid models of human and mouse ductal pancreatic cancer. Cell 160, 324–338 (2015).
[11] Y eung, T . M., Gandhi, S. C., Wilding, J. L., Muschel, R.& Bodmer, W. F . Cancer stem cells from colorectal cancer-derived cell lines. Proc. Natl Acad. Sci. USA 107, 3722–3727 (2010).
[12] Schwank, G. et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell 13, 653–658 (2013).
[13] Daviaud N, Chevalier C, Friedel RH, Zou H. Distinct Vulnerability and Resilience of Human Neuroprogenitor Subtypes in Cerebral Organoid Model of Prenatal Hypoxic Injury. Front Cell Neurosci. 2019 Jul 30;13:336. doi: 10.3389/fncel.2019.00336. PMID: 31417360; PMCID: PMC6682705.
[14] Bohrer LR, Stone NE, Mullin NK, Voigt AP, Anfinson KR, Fick JL, Luangphakdy V, Hittle B, Powell K, Muschler GF, Mullins RF, Stone EM, Tucker BA. Automating iPSC generation to enable autologous photoreceptor cell replacement therapy. J Transl Med. 2023 Feb 28;21(1):161. doi: 10.1186/s12967-023-03966-2. PMID: 36855199; PMCID: PMC9976478.





