高濃度葡萄糖對周細胞樣分化的人脂肪源性間充質干細胞的影響
在過去的幾十年中,人脂肪源性間充質干細胞(ASCs)的多向分化能力因其在基于干細胞的治療策略中的潛在應用而得到了廣泛的研究。目前正在探索基于干細胞的療法來治療眼部疾病,包括糖尿病視網膜病變(DR),其中血管并發癥導致血-視網膜屏障(BRB)破壞。
微循環損傷主要歸因于周細胞的不可逆丟失,這是DR的早期標志,因為在成人視網膜中,周細胞無法復制。高血糖引起的活性氧(ROS)的過量產生刺激炎癥過程,導致視網膜血管損傷。在DR患者中發現不同炎性細胞因子(如IL-1β)和腫瘤壞死因子-α(TNF-α)水平升高。活化的小膠質細胞、內皮細胞和大膠質細胞參與這些細胞因子的分泌,其積累有助于神經元死亡。此外,血管內皮生長因子(VEGF)和血管生成素-2等促血管生成因子已被證明可誘導內皮細胞增殖,最終導致血管通透性增加和破裂。
基于干細胞的療法可能是抵消周細胞丟失和減緩疾病進展的寶貴工具。體外實驗和DR小鼠模型曾報道了令人鼓舞的結果。在意大利卡塔尼亞大學生物醫學與生物技術科學系團隊之前的體外研究中,通過在專為周細胞(PM)設計的培養基中培養ASCs,實現了ASCs的周細胞樣分化。結果,獲得了平滑肌肌動蛋白α(α-SMA)和神經膠質抗原2(NG2)的過表達,以及它們典型的腎小管周圍定位。此外,周細胞樣分化ASCs和人視網膜內皮細胞(HRECs)的共培養誘導了連接蛋白的表達增加。它們也將被稱為pmASCs,因為它們的分化過程也是通過使用PM實現的。
該團隊下一項研究的目的是進一步探索通過相同分化方案獲得的這些pmASCs的行為,特別是,為了模擬糖尿病患者發生的狀況,在向培養基中加入葡萄糖后測量和比較各種參數。實驗評估了細胞增殖、細胞活力及其遷移能力;還測量了ROS的產生以及促炎(TNF-α和IL-1β)和抗炎(TGF-β1和IL-10)細胞因子、促血管生成因子(VEGF,血管生成素-2和MMP-9)的mRNA表達;最后通過3D共培養評估了pmASC對HREC組織管狀形成能力的影響。在這些結果中獲得的周細胞樣ASCs代表了治療糖尿病患者視網膜損傷的寶貴數據。

首先,進行細胞增殖和活性檢測。盡管存在顯著差異,但在所有測試的ASC群體中均觀察到高增殖率。圖1顯示了所研究的所有四個亞組中典型的成纖維細胞樣形態。可以觀察到,無論葡萄糖濃度如何,pmASC培養物中存在更密集的細胞群(圖1 B、D),在較長時間內可能會注意到輕微下降。添加葡萄糖對這些細胞種群的影響不顯著。相反,高葡萄糖濃度對人視網膜周細胞(HRPCs)的增殖率產生負面影響,其增殖率逐漸降低,特別是在葡萄糖添加72小時。通過MTT測定細胞活力,pmASCs與ASCs在每個時間點的任何葡萄糖濃度下都顯示出相似的高值,相反,在HRPC種群中測量到較低值,添加葡萄糖48小時和72小時后逐漸觀察到顯著下降。
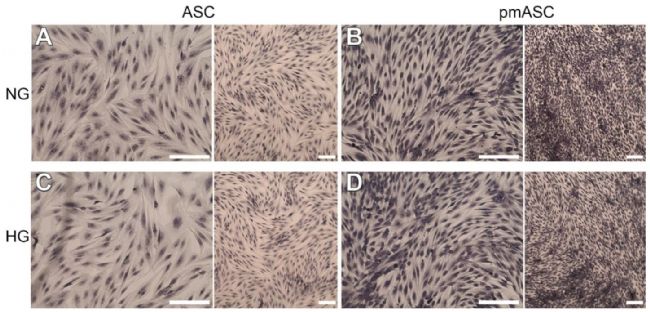 圖1 在基礎培養基(ASC)或周細胞培養基(pmASC)中培養的人脂肪間充質干細胞的代表性顯微照片,在細胞增殖測定期間用結晶紫染色。在各自的培養基中生長三天后,在一些樣本(高葡萄糖,25 mM)中添加葡萄糖,而其他樣本則保持在正常葡萄糖(NG)狀態。在葡萄糖添加72小時后拍攝照片,并與NG對照進行比較。四個亞組為A:ASC NG;B: pmASC NG;C: ASC HG;D: pmASC HG。
圖1 在基礎培養基(ASC)或周細胞培養基(pmASC)中培養的人脂肪間充質干細胞的代表性顯微照片,在細胞增殖測定期間用結晶紫染色。在各自的培養基中生長三天后,在一些樣本(高葡萄糖,25 mM)中添加葡萄糖,而其他樣本則保持在正常葡萄糖(NG)狀態。在葡萄糖添加72小時后拍攝照片,并與NG對照進行比較。四個亞組為A:ASC NG;B: pmASC NG;C: ASC HG;D: pmASC HG。
接下來,與HRPCs相比,進行了傷口愈合測定以評估不同ASC亞組的細胞遷移能力(圖2 A)。數據顯示,在NG條件下培養時,ASCs和pmASCs在48小時的觀察期內表現出顯著的遷移能力,傷口愈合率約為70%(圖2 B)。將葡萄糖加入培養基(HG)時觀察到顯著差異,與pmASCs相比,ASCs(傷口愈合率約為35%)明顯顯示出相反的趨勢。在傷口愈合率約為70% 的HRPCs 中觀察到中間值(圖2 C)。HG條件下,pmASCs的相關細胞遷移能力在48小時時尤為明顯。
 圖2 通過基礎培養基(ASC)或周細胞培養基(pmASC)中培養的人脂肪間充質干細胞以及人視網膜周細胞(HRPC)培養物中的傷口愈合測定評估細胞遷移能力。(A)在劃痕(0小時),培養24小時和48小時后每個樣品的代表性照片。量化ASC和pm ASC培養(B)和HRPC培養(C)的傷口愈合百分比。
圖2 通過基礎培養基(ASC)或周細胞培養基(pmASC)中培養的人脂肪間充質干細胞以及人視網膜周細胞(HRPC)培養物中的傷口愈合測定評估細胞遷移能力。(A)在劃痕(0小時),培養24小時和48小時后每個樣品的代表性照片。量化ASC和pm ASC培養(B)和HRPC培養(C)的傷口愈合百分比。
然后評估了每個ASC亞組和HRPC群的ROS水平,在觀察期內,ASC種群中ROS水平逐漸增加,而pmASCs在每個相應時間點檢測到穩定且顯著降低的水平。加入葡萄糖后,每個ASC組內未觀察到明顯變化,而在HRPC培養組中觀察到不同的趨勢,72小時后觀察到其顯著更高的ROS水平。
在進一步的實驗中,在NG和HG條件下,通過定量RT-PCR分析ASC和pmASC培養物中炎癥相關細胞因子mRNA水平(圖3)。在NG條件下培養時,ASCs和pmASCs之間的抗炎細胞因子IL-10 mRNA表達沒有明顯差異,而在HG條件下,ASC培養物中略高的IL-10 mRNA水平在pmASCs中增加了25倍。此外,與ASC培養物相比,pmASC培養物中的TGF-β1 mRNA水平升高,特別是在HG條件下。在NG條件下ASC和pmASC培養物中檢測到相似的促炎細胞因子TNF-α mRNA水平,而在HG條件下,與ASCs中更顯著的增加相比,pmASC僅觀察到微弱升高的水平。與ASCs相比,NG條件下的IL-1β mRNA水平在pmASC中顯著降低,而在HG培養中,ASCs中測量的水平較低,而pmASCs中沒有顯著差異。
此外,評估了血管生成因子VEGF,血管生成素-2和MMP9的mRNA表達水平。在HG培養的ASC中,VEGF和血管生成素-2值均增加,而在pmASCs中的較低水平未受顯著影響。MMP9 mRNA在NG條件下水平較低,添加葡萄糖后在ASCs中顯著更高,在pmASCs中甚至更低。這些數據表明,炎癥基因的調節有利于抗炎表型,同時,血管生成因子普遍降低。
 圖3 高葡萄糖對在基礎培養基(ASC)或周細胞培養基(pmASC)中培養的人脂肪間充質干細胞中的抗炎和促炎細胞因子以及血管生成因子的影響。通過qRT-PCR評估IL 10(A)、TGF-β1(B)、TNFα(C)、IL-1β(D)、VEGF(E)、血管生成素-2(F)和MMP9(G)mRNA水平的定量分析。
圖3 高葡萄糖對在基礎培養基(ASC)或周細胞培養基(pmASC)中培養的人脂肪間充質干細胞中的抗炎和促炎細胞因子以及血管生成因子的影響。通過qRT-PCR評估IL 10(A)、TGF-β1(B)、TNFα(C)、IL-1β(D)、VEGF(E)、血管生成素-2(F)和MMP9(G)mRNA水平的定量分析。
最后,在3D共培養中測試了HRECs與ASCs或pmASCs之間的相互作用,分析了HREC自組裝的管狀結構引起的修飾(圖4 A)。定量數據顯示,在HG與NG條件下,HRECs 的小管總主干長度值較低(圖4 B),與ASCs共培養時也是如此,相反,與pmASCs共培養的HRECs測量到更高的值。在HG與NG條件下,對于總分離分支長度(圖4 C)呈相反趨勢,HRECs和 HRECs + ASCs 產生更高的值,而HRECs + pmASCs的值明顯較低。圖4 D所示的分支點測量值與主干和分離分支長度值非常吻合。添加葡萄糖后,HRECs和HRECs + ASCs共培養中的分支點數較低,HRECs + pmASCs的共培養中分支點數較高。正如預期的那樣,分支點的數量隨著總主干長度值的增加而成比例增加,并且與總分離分支長度成反比。這可能表明,同樣在高葡萄糖條件下,周細胞樣ASCs的存在會誘導更有組織的血管網絡。
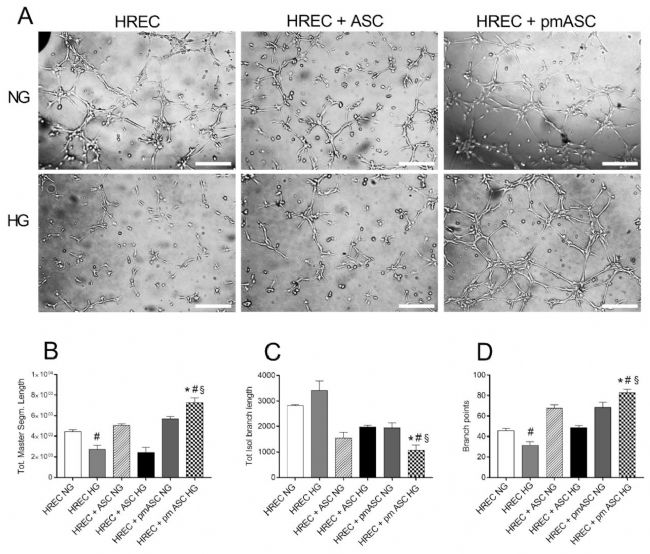 圖4 高葡萄糖對人視網膜內皮細胞(HREC)或與ASCs(HREC + ASC)或pmASCs(HREC + pmASC)共培養的管狀結構形成的影響。(A)代表性顯微照片顯示了每個樣本的基質膠中的3D培養物。底部的直方圖顯示total master segment length “總主干長度”(B)、total isolated branch length“總分離分支長度”(C)和branching points “分支點”(D)。
圖4 高葡萄糖對人視網膜內皮細胞(HREC)或與ASCs(HREC + ASC)或pmASCs(HREC + pmASC)共培養的管狀結構形成的影響。(A)代表性顯微照片顯示了每個樣本的基質膠中的3D培養物。底部的直方圖顯示total master segment length “總主干長度”(B)、total isolated branch length“總分離分支長度”(C)和branching points “分支點”(D)。
總之,這項工作獲得的結果令人鼓舞,因為即使在高葡萄糖濃度存在的情況下,周細胞樣ASCs也具有顯著的活力,高增殖率和顯著的遷移能力。此外,觀察到ROS,促炎細胞因子和促血管生成因子的產生減少,以及抗炎細胞因子的產生增加。最后,對HREC管狀形成結果觀察到了積極的影響,這些表明,特定的上游處理有助于優化基于干細胞的治療應用。當這些周細胞樣ASCs植入體內時,這些在體外獲得的結果是否真的提供了有益的效果,還有待驗證。
參考文獻:Mannino G, Longo A, Gennuso F, Anfuso CD, Lupo G, Giurdanella G, Giuffrida R, Lo Furno D. Effects of High Glucose Concentration on Pericyte-Like Differentiated Human Adipose-Derived Mesenchymal Stem Cells. Int J Mol Sci. 2021 Apr 27;22(9):4604. doi: 10.3390/ijms22094604. PMID: 33925714; PMCID: PMC8125146.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/33925714/
Impact Factor: 5.6 (2022); 5-Year Impact Factor: 6.2 (2022)
ISSN: 1422-0067
小編旨在分享、學習、交流生物科學等域的研究進展。如有侵權或引文不當請聯系小編修正。
微信搜索公眾號“Naturethink”,了解更多細胞體外仿生培養技術及應用。
微循環損傷主要歸因于周細胞的不可逆丟失,這是DR的早期標志,因為在成人視網膜中,周細胞無法復制。高血糖引起的活性氧(ROS)的過量產生刺激炎癥過程,導致視網膜血管損傷。在DR患者中發現不同炎性細胞因子(如IL-1β)和腫瘤壞死因子-α(TNF-α)水平升高。活化的小膠質細胞、內皮細胞和大膠質細胞參與這些細胞因子的分泌,其積累有助于神經元死亡。此外,血管內皮生長因子(VEGF)和血管生成素-2等促血管生成因子已被證明可誘導內皮細胞增殖,最終導致血管通透性增加和破裂。
基于干細胞的療法可能是抵消周細胞丟失和減緩疾病進展的寶貴工具。體外實驗和DR小鼠模型曾報道了令人鼓舞的結果。在意大利卡塔尼亞大學生物醫學與生物技術科學系團隊之前的體外研究中,通過在專為周細胞(PM)設計的培養基中培養ASCs,實現了ASCs的周細胞樣分化。結果,獲得了平滑肌肌動蛋白α(α-SMA)和神經膠質抗原2(NG2)的過表達,以及它們典型的腎小管周圍定位。此外,周細胞樣分化ASCs和人視網膜內皮細胞(HRECs)的共培養誘導了連接蛋白的表達增加。它們也將被稱為pmASCs,因為它們的分化過程也是通過使用PM實現的。
該團隊下一項研究的目的是進一步探索通過相同分化方案獲得的這些pmASCs的行為,特別是,為了模擬糖尿病患者發生的狀況,在向培養基中加入葡萄糖后測量和比較各種參數。實驗評估了細胞增殖、細胞活力及其遷移能力;還測量了ROS的產生以及促炎(TNF-α和IL-1β)和抗炎(TGF-β1和IL-10)細胞因子、促血管生成因子(VEGF,血管生成素-2和MMP-9)的mRNA表達;最后通過3D共培養評估了pmASC對HREC組織管狀形成能力的影響。在這些結果中獲得的周細胞樣ASCs代表了治療糖尿病患者視網膜損傷的寶貴數據。

首先,進行細胞增殖和活性檢測。盡管存在顯著差異,但在所有測試的ASC群體中均觀察到高增殖率。圖1顯示了所研究的所有四個亞組中典型的成纖維細胞樣形態。可以觀察到,無論葡萄糖濃度如何,pmASC培養物中存在更密集的細胞群(圖1 B、D),在較長時間內可能會注意到輕微下降。添加葡萄糖對這些細胞種群的影響不顯著。相反,高葡萄糖濃度對人視網膜周細胞(HRPCs)的增殖率產生負面影響,其增殖率逐漸降低,特別是在葡萄糖添加72小時。通過MTT測定細胞活力,pmASCs與ASCs在每個時間點的任何葡萄糖濃度下都顯示出相似的高值,相反,在HRPC種群中測量到較低值,添加葡萄糖48小時和72小時后逐漸觀察到顯著下降。

接下來,與HRPCs相比,進行了傷口愈合測定以評估不同ASC亞組的細胞遷移能力(圖2 A)。數據顯示,在NG條件下培養時,ASCs和pmASCs在48小時的觀察期內表現出顯著的遷移能力,傷口愈合率約為70%(圖2 B)。將葡萄糖加入培養基(HG)時觀察到顯著差異,與pmASCs相比,ASCs(傷口愈合率約為35%)明顯顯示出相反的趨勢。在傷口愈合率約為70% 的HRPCs 中觀察到中間值(圖2 C)。HG條件下,pmASCs的相關細胞遷移能力在48小時時尤為明顯。

然后評估了每個ASC亞組和HRPC群的ROS水平,在觀察期內,ASC種群中ROS水平逐漸增加,而pmASCs在每個相應時間點檢測到穩定且顯著降低的水平。加入葡萄糖后,每個ASC組內未觀察到明顯變化,而在HRPC培養組中觀察到不同的趨勢,72小時后觀察到其顯著更高的ROS水平。
在進一步的實驗中,在NG和HG條件下,通過定量RT-PCR分析ASC和pmASC培養物中炎癥相關細胞因子mRNA水平(圖3)。在NG條件下培養時,ASCs和pmASCs之間的抗炎細胞因子IL-10 mRNA表達沒有明顯差異,而在HG條件下,ASC培養物中略高的IL-10 mRNA水平在pmASCs中增加了25倍。此外,與ASC培養物相比,pmASC培養物中的TGF-β1 mRNA水平升高,特別是在HG條件下。在NG條件下ASC和pmASC培養物中檢測到相似的促炎細胞因子TNF-α mRNA水平,而在HG條件下,與ASCs中更顯著的增加相比,pmASC僅觀察到微弱升高的水平。與ASCs相比,NG條件下的IL-1β mRNA水平在pmASC中顯著降低,而在HG培養中,ASCs中測量的水平較低,而pmASCs中沒有顯著差異。
此外,評估了血管生成因子VEGF,血管生成素-2和MMP9的mRNA表達水平。在HG培養的ASC中,VEGF和血管生成素-2值均增加,而在pmASCs中的較低水平未受顯著影響。MMP9 mRNA在NG條件下水平較低,添加葡萄糖后在ASCs中顯著更高,在pmASCs中甚至更低。這些數據表明,炎癥基因的調節有利于抗炎表型,同時,血管生成因子普遍降低。

最后,在3D共培養中測試了HRECs與ASCs或pmASCs之間的相互作用,分析了HREC自組裝的管狀結構引起的修飾(圖4 A)。定量數據顯示,在HG與NG條件下,HRECs 的小管總主干長度值較低(圖4 B),與ASCs共培養時也是如此,相反,與pmASCs共培養的HRECs測量到更高的值。在HG與NG條件下,對于總分離分支長度(圖4 C)呈相反趨勢,HRECs和 HRECs + ASCs 產生更高的值,而HRECs + pmASCs的值明顯較低。圖4 D所示的分支點測量值與主干和分離分支長度值非常吻合。添加葡萄糖后,HRECs和HRECs + ASCs共培養中的分支點數較低,HRECs + pmASCs的共培養中分支點數較高。正如預期的那樣,分支點的數量隨著總主干長度值的增加而成比例增加,并且與總分離分支長度成反比。這可能表明,同樣在高葡萄糖條件下,周細胞樣ASCs的存在會誘導更有組織的血管網絡。

總之,這項工作獲得的結果令人鼓舞,因為即使在高葡萄糖濃度存在的情況下,周細胞樣ASCs也具有顯著的活力,高增殖率和顯著的遷移能力。此外,觀察到ROS,促炎細胞因子和促血管生成因子的產生減少,以及抗炎細胞因子的產生增加。最后,對HREC管狀形成結果觀察到了積極的影響,這些表明,特定的上游處理有助于優化基于干細胞的治療應用。當這些周細胞樣ASCs植入體內時,這些在體外獲得的結果是否真的提供了有益的效果,還有待驗證。
參考文獻:Mannino G, Longo A, Gennuso F, Anfuso CD, Lupo G, Giurdanella G, Giuffrida R, Lo Furno D. Effects of High Glucose Concentration on Pericyte-Like Differentiated Human Adipose-Derived Mesenchymal Stem Cells. Int J Mol Sci. 2021 Apr 27;22(9):4604. doi: 10.3390/ijms22094604. PMID: 33925714; PMCID: PMC8125146.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/33925714/
Impact Factor: 5.6 (2022); 5-Year Impact Factor: 6.2 (2022)
ISSN: 1422-0067
小編旨在分享、學習、交流生物科學等域的研究進展。如有侵權或引文不當請聯系小編修正。
微信搜索公眾號“Naturethink”,了解更多細胞體外仿生培養技術及應用。
| Naturethink細胞共培養 http://www.nkkfm.com/show1equip4139865.html |
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





