腹腔內窺鏡手術系統和高頻手術設備注冊審查指導原則(2023修訂版)
 根據國家藥品監督管理局2023年度醫療器械注冊審查指導原則制修訂計劃的有關要求,醫療器械技術審評中心組織編制了《角膜地形圖儀注冊審查指導原則(征求意見稿)》《腹腔內窺鏡手術系統注冊審查指導原則第2部分:動物試驗決策判定和要求(征求意見稿)》《高頻手術設備注冊審查指導原則(2023年修訂版)(征求意見稿)》《影像型超聲診斷設備(第三類)注冊審查指導原則(2023年修訂版)(征求意見稿)》等4項指導原則。
根據國家藥品監督管理局2023年度醫療器械注冊審查指導原則制修訂計劃的有關要求,醫療器械技術審評中心組織編制了《角膜地形圖儀注冊審查指導原則(征求意見稿)》《腹腔內窺鏡手術系統注冊審查指導原則第2部分:動物試驗決策判定和要求(征求意見稿)》《高頻手術設備注冊審查指導原則(2023年修訂版)(征求意見稿)》《影像型超聲診斷設備(第三類)注冊審查指導原則(2023年修訂版)(征求意見稿)》等4項指導原則。
同時,為進一步規范近視/弱視激光治療儀的技術審評,加強該類產品的監管管理,器審中心組織編制了《近視/弱視激光治療儀技術審評要點(征求意見稿)》。經調研、討論,現已形成征求意見稿(附件1-5),即日起在網上公開征求意見。
以下是對《腹腔內窺鏡手術系統注冊審查指導原則第2部分:動物試驗決策判定和要求(征求意見稿)》《高頻手術設備注冊審查指導原則(2023年修訂版)(征求意見稿)》的簡要介紹,詳細內容請見鏈接:
關于公開征求《角膜地形圖儀注冊審查指導原則(征求意見稿)》等5項醫療器械注冊審查指導原則和技術審評要點意見的通知 (cmde.org.cn)yj/20230928133259158.html
腹腔內窺鏡手術系統注冊審查指導原則第2部分:動物試驗決策判定和要求(征求意見稿)
適用范圍:本指導原則適用于多孔的腹腔內窺鏡手術系統的動物試驗設計與實施,旨在指導注冊申請人科學地開展手術機器人動物試驗研究,不適用于在非活體動物、離體組織或器官上進行的研究。
公司案例
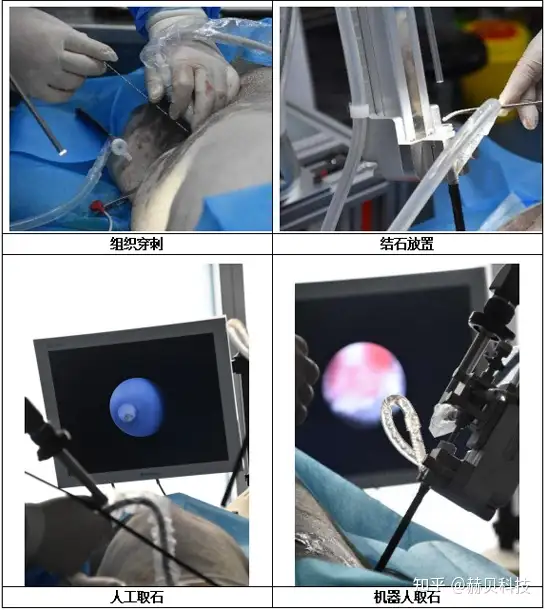
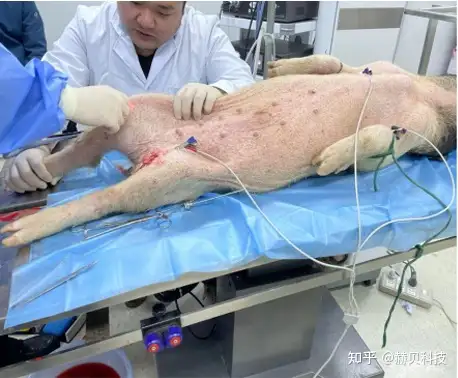
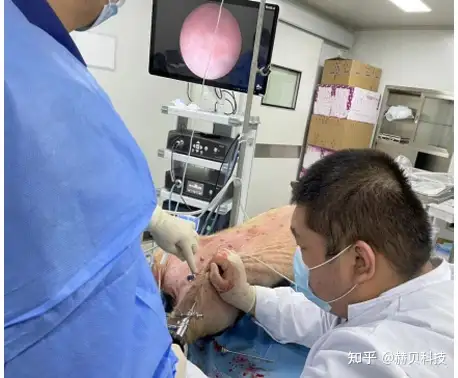
實驗目的:模擬PCNL經皮腎鏡手術機器人的臨床手術方式進行取石,評估供試手術機器人與傳統腔鏡下手術方式的優劣性
動物選擇:大白豬
動物數量:3只
分組:手術機器人取石組(左腎)、傳統手術方式取石組(右腎)
取石時間:植入后即刻開始取石操作
檢測指標:取石成功率及手術時間、機械臂穩定性觀察、灌注吸引流量和腎內壓、血管出血情況和組織損傷、腎組織病理觀察

《高頻手術設備注冊審查指導原則(2023年修訂版)(征求意見稿)》
適用范圍:本指導原則所述高頻手術設備是指“產生高頻電流的醫用電氣設備,預期利用高頻電流進行外科作業,如對生物組織切(割)或凝(固)”。對于特殊臨床使用方式或特定適應癥的高頻手術設備(如等離子手術設備、大血管閉合設備等),除本指導原則外如有專門針對其所制定的指導原則,則該指導原則中的相應內容可作為本指導原則的補充或替代部分。對于同時具有高頻和其他輸出能量(如機械效應、超聲效應、激光或輻照效應等)的手術設備,其高頻輸出部分應遵守本指導原則的內容,其他輸出方式應遵守相應的指導原則或審查要求,同時還應考慮二者結合所帶來的額外風險和臨床效果。本指導原則不適用于婦科、腫瘤或心臟等射頻消融設備,以及利用射頻能量進行整形/美容的非消融類射頻治療設備。本指導原則不適用于電加熱烙燒設備和熱療類產品。本指導原則不包括高頻附件中手術附件和中性電極的要求,如結構組成中含手術附件和中性電極,可參考相應指導原則的要求。
公司案例
實驗目的:通過活體動物研究比較受試射頻消融系統和參比產品的性能及安全性
動物選擇:小型巴馬香豬
動物數量:10只
分組:RJ8517009組、RJ8517012組、RJ8517017組
檢測指標:血液學檢查、肌肉凝血操作時間、肌肉損傷面積、HE染色、軟骨組織碳化區域占比、韌帶組織碳化區域占比、韌帶電切深度統計
關于赫貝
赫貝科技有限公司(以下簡稱赫貝)專業從事臨床前CRO服務的國家高新技術企業,是浙江省級研發中心和省級創新載體,浙江省專精特新中小企業,具備藥理毒理評價資質、實驗動物許可,質量體系已通過CNAS ISO17025認可。
公司擁有6000多平方的專業生物實驗室以及SPF實驗動物中心,涵蓋小動物(小鼠、大鼠、豚鼠、兔子)大動物(豬、犬、羊、猴)等多種實驗動物,擁有百余種動物疾病模型復制經驗并配套完整的生物學檢測服務。設有八大技術服務平臺,涵蓋疾病動物模型、分子生物學、細胞生物學、病理學,影像學,行為學等,嚴格按照GLP實驗室標準執行。為客戶提供可定制的臨床前試驗服務方案。
赫貝始終密切關注創新型醫療器械研發的最新動向以及臨床前生物相容性、安全有效性評價政策法規,可提供有源器械、無源器械、植入器械、醫療美容器械等多種二、三類醫療器械的可行性研究和臨床前安全有效性評價,目前已推動多項醫療器械產品通過NMPA審批進入臨床階段和成功上市。





