FIDA技術的應用:通過流動誘導分散分析(FIDA)技術表征構象變化
· 蛋白質 - 小分子相互作表征
· 天然條件和微量樣品檢測
· 同時評估結合親和力,構象變化和絕對大小
介紹
許多生物學過程通過蛋白與小分子或其他蛋白的相互作用進行調節。在許多情況下,這些相互作用會引起構象變化,該變化直接調節活性或提供新的結合位點,以促進建立高階復合物。作為模型系統,本次實驗我們使用了細菌性結合蛋白超家族的麥芽糖結合蛋白(MBP)。
MBP是麥芽糖糊精轉運系統的可溶組分,駐留在革蘭氏陰性細菌的周質中,在該細菌的周質中,它可以將其配體(Maltose,Maltotriose和Maltoheptaose)運送到膜結合的轉運蛋白復合物。MBP的配體結合位點位于兩個球狀結構域之間。
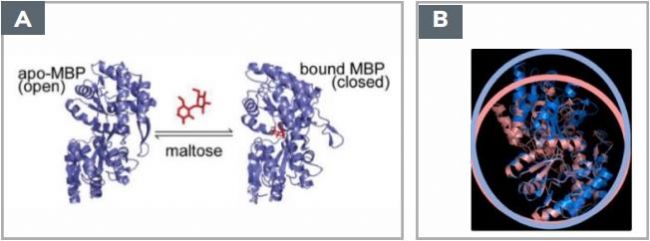
圖1.(a)MBP(42.5 kDa)Apo狀態(左,開放)以及與Maltose(360 Dalton)結合形成的麥芽糖結合態MBP(右,關閉);(b)MBP的開放式(淺藍色)和封閉式(淺粉紅色)結構的對比。
材料和方法
該實驗采用FIDA Neo儀器,480 nm LED熒光檢測模塊(FIDABIO ApS)。
1. 耗材:FIDA標準毛細管(i.d.:75 µm,LT:100cm,Leff:84 cm)。
2. 緩沖液:Tris緩沖液pH 7.4(20mm Tris,150mmNaCl,0.05%Tween)。
3. 指示劑:MBP(4.3ug/mL,100nM), MBP用Atto 488 NHS (Sigma Aldrich)標記。
4. 分析物:麥芽糖(O-α-D-Glucopyranosyl-D-glucose),0-1000 µM。
通過用分析物填充毛細管,然后注射指示劑與分析物共孵育混合物,在400 mbar下流經探測器進行樣品分析。
結果
麥芽糖會引起麥芽糖結合蛋白的構象變化。
FIDA技術提供了對流體動力半徑(Rh)的絕對測量,并用于測量與麥芽糖(0.3 kDa)結合后ATTO488標記的MBP(42.5 kDa)的尺寸變化。如圖2A所示,在25°C下繪制了MBP表觀Rh隨麥芽糖濃度(0-1000 µM)變化的函數曲線。MBP的Rh從2.88nm降低至2.62nm,對應于0.26nm的ΔRh,清楚地表明結合后的結構變化(圖2A)。結合數學模型,通過流體動力半徑(Rh)變化的數據解析,該相互作用親和力KD≈10 µM,與文獻[1,2]報道一致。在圖2中,顯示了單獨MBP和MBP-麥芽糖的疊加FIDA信號。在圖2B中,指示劑峰在麥芽糖存在下變窄。利用FIDA 泰勒分散分布圖的峰面積,可同時探測MBP的熒光強度在增加麥芽糖濃度時因MBP與麥芽糖結合發生的變化,即結合相關熒光強度變化(BRIC,Binding Realted Intensity Change)。它表明,MBP的熒光信號受麥芽糖結合的影響(圖2B),利用BRIC信號可從第二個維度解析二者親和力常數KD≈10 µM,從而實現結合測量的正交估計。

圖2.(A)由FIDA在25°C分析的MBP和麥芽糖之間的相關結合曲線。即MBP的Rh隨麥芽糖濃度(0-1000 µM)變化的函數曲線。(B)與單獨的MBP(實線)相比,當存在麥芽糖(虛線)時,指示劑峰的原始數據曲線變得更窄。
結論
本文的數據顯示了如何使用FIDA技術對蛋白質的構象變化進行測量。FIDA通過測量蛋白質的流動性半徑(5 µL樣品消耗)來深入評估活性以及局部和全局蛋白質結構變化。在一個平臺,同時采用2種方法解析分子互作親和力常數,正交測量,相互驗證。

分子互作與穩定性分析系統
FIDA技術無論在傳統的生物大分子、小分子互作分析,還是三元復合物,血清、血漿、粗提物中互作分析都有很好的適用性,而且在一些傳統互作技術具有挑戰性的領域,例如免純化樣本、脂質體、外泌體、GPCR互作分析領域具有獨特的優勢,FIDA技術擴展了互作方法的應用領域,非常有利于實驗平臺進行分子互作儀器技術升級。
FIDA技術在分子質量表征方面同樣優秀,一次運行只需4微升樣品4分鐘的時間即可獲取多達8個質量參數,其中流體力學半徑(Rh)和粘度(Viscosity)為絕對數值,黏性(Stickiness)是FIDA的獨家指標,聚集和多分散系數(PDI)為量化參數。FIDA可以用在任何蛋白相關的實驗,包括蛋白質控,蛋白穩定性篩選、制劑篩選等常規方向,還可在液-液相分離(LLPS),冷凍電鏡樣本制備質控、蛋白表達體系篩選等領域有很好的解決方案。
產品特點
1. 無固定相:溶液中直接檢測分子相互作用
2. 無標記或熒光標記
3. 靈敏度:Rh范圍0.5-500nm
4. 分辨率:檢測到<5%Rh變化
5. 親和力范圍:pM-mM
6. 分析物上樣體積:≤4μL
7. 每個數據點8個質控參數
8. 適用于各種樣本類型,包括免純化蛋白、無緩沖液限制
應用領域






