FIDA技術對小分子相互作用研究的多個案例分享
膜蛋白與小分子|三元復合物|磷酸酶與小分子|小分子結合引起構象變化|蛋白聚集體與小分子
小分子互作研究仍然是當今互作研究領域具有挑戰性的方向之一,FIDA技術由于在底層物理原理上的優勢,可以解決現有互作方法無法克服的一系列問題,例如結合質量變化不敏感,蛋白不穩定,結合構象變化小,蛋白表達量少,無法正交驗證互作數據,多元互作無法有效表征,以及親和力無法提供QC數據而存疑等問題,都制約小分子研究。而FIDA技術的出現有望打破互作行業內方法學的局限性,讓小分子的互作研究更快,更準,更簡單。以下匯總現有FIDA的一些案例,供大家參考。
應用一:FIDA多維膜蛋白與小分子互作解決方案
表征膜蛋白在體外的相互作用是一個重大的挑戰,主要是由于膜蛋白在無配體狀態和結合狀態之間的質量變化十分微弱。這使得依靠一些通過使用分子質量變化來檢測分子互作的的方法的不能獲取有效的數據。
FIDA分子互作儀基于微流體的Taylor色散和Stokes-Einstein方程的物理原理,FIDA是表征絕對生物分子大小和相互作用的獨特技術,原始數據包含廣泛的信息,包括以流體動力半徑Rh和BRIC(結合依賴的熒光強度變化)兩種方式同步擬合親和力數據,而且兩種方式是完全正交且獨立的,分別代表了其分子的粒徑變化和構象變化,可以完美解決膜蛋白結合小分子后結合質量變化不敏感的問題。
此外,FIDA還是極其靈敏的Labelfree分子構象分析儀,通過全自動的化學變性實驗可檢測吉布斯結合自由能,即使蛋白不含有色氨酸殘基,FIDA可檢測到低至0.07ug/mL的低豐度蛋白(分子僅含有4個酪氨酸殘基),大幅優于傳統的nanoDSF技術,非常適合于珍貴的樣品互作與穩定性實驗。

圖1. FIDA多維表征膜蛋白和小分子互作實驗流程
FIDA中檢測膜蛋白與小分子互作的同時引起Rh大小與熒光變化

用于滴定的膜蛋白總消耗量僅為 1.44 μL。實驗觀察到了明顯BRIC信號變化,采用標準的 1:1 模型進行擬合(圖 2b)。通過繪制水動力半徑隨配體濃度變化的圖,揭示出一個顯著的模式(圖2a)。最初的粒徑增加對應于0.5 nm的大小,在觀察到BRIC的一半時達到平臺期。這表明膜蛋白在滴定開始時采用了比起初更為擴展的構象。在這之后,出現了1.2 nm的收縮,表明膜蛋白從擴展構象轉變為飽和復合物中的收縮形式。一種可能的解釋是該蛋白質有兩個小分子的結合位點。
這突出了通過Fida表征小分子-膜蛋白相互作用的額外好處,因為你不僅可以觀察nL樣品中Rh的變化,而且還可以因為相互作用而深入了解構象結構的變化。
來源:Fidabio Appnote https://www.fidabio.com/literature/small-molecule-interactions-with-membrane-proteins
應用二:FIDA “All-in-one”表征三元復合物——自動化In-Solution方案
Fida 分子互作儀可以提供快速、準確的測定三元復合物形成,Fida獨有的三元復合物模型只需通過一次實驗,“All-in-one”即可分析不同復合物的大小、百分比、親和力和協同性等參數。本案例介紹了靶蛋白GSPT1、連接酶CRBN-DDB1、分子膠X (MGX)和來那度胺的研究。
首先測定未結合GSPT1的大小為4.27±0.06 nm。用100 nM的CRBN-DDB1混合物在Mol Glue X分子膠濃度增加的情況下進行滴定,產生s形結合曲線,證實三元復合物形成,總親和力為11.1 nM。與CRBN-DDB1相同的滴定和來那度胺濃度的增加,但沒有增加GSPT1的大小,即沒有形成三元復合物。

圖3.Mol Glue X,來那度胺和CRBN-DDB1,GSPT1三元復合物親和力檢測
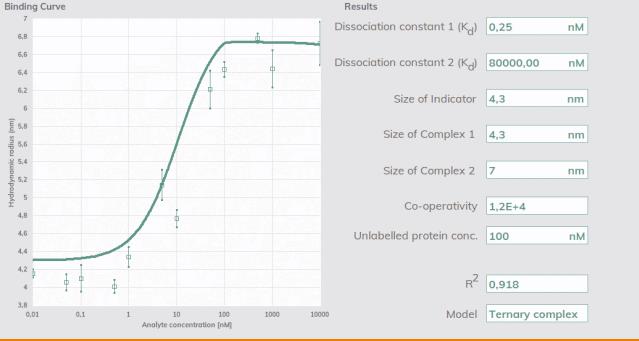
圖4.Fidabio軟件對參數分析界面
在軟件擬合模型中對實驗數據集進行擬合得到的參數:
- Kd(親和GSPT1和分子膠)
- Kd 2(親和CRBN-DDB1和分子膠)
-協同系數(α)
-INDICATOR(GSPT1)的大小(Rh)
-二元復合物的大小(Rh)(GSPT1-分子膠)
-三元復合物的大小(Rh)(GSPT1-分子膠- crbn - ddb1)
Fida 分子互作儀提供了自動化的溶液內分析平臺,通過Rh和BRIC(結合相關熒光強度變化)的正交讀數來表征三元復合物的形成。在本例中,生成的數據分別為Molecular Glue X及其與靶蛋白和蛋白酶的相互作用。實驗數據用Fidabio軟件進行自動擬合,只需一次實驗就可以獲得表征三元復合物需要的所有參數(Kds, α和復合物尺寸-包括三元復合物的尺寸以及百分比)。
來源:Fidabio Appnote https://www.fidabio.com/literature/characterization-of-molecular-glues-an-automated-in-solution-platform
應用三:FIDA表征磷酸酶和小分子互作——腫瘤新靶點抑制劑研究
本案例中EYA1是一種鹵酸脫鹵酶磷酸酶和轉錄因子,在SHH髓母細胞瘤(SHH- mb)的腫瘤發生和增殖中起關鍵作用。苯扎酮已被確定為EYA蛋白的變構抑制劑。以苯扎酮為出發點,開發了DS-1-38(分子量347.42)作為EYA拮抗劑,并利用FIDA得到親和力數據。

圖5.EYA1全長與DS38 (E)和DS60 (F)的FIDA檢測結果。DS38與EYA1結合,DS60不結合
為了確定DS38是否直接與EYA1結合,在案例中使用FIDA評估了當純化蛋白與單個小分子化合物直接結合時,全長EYA1或EYA1催化結構域的構象變化,其中圖E下方的熒光強度數據可得出,當DS38與EYA結合時熒光值變小,可得出結合后EYA1蛋白從擴展的構象變為塌陷的形式。
研究者在磷酸酶相關研究中都采用了FIDA,因為這種方法非常靈敏而且,對于使用少量自動熒光蛋白定量評估結合非常有用。通過這種方法,我們可以觀察到EYA1的表觀流體動力半徑(Rh)和熒光信號隨多肽或小分子濃度的增加而明顯變化。
來源:Grace H. Hwang, Maria F. Pazyra-Murphy, Hyuk-Soo Seo, Sirano Dhe-Paganon, Sylwia A. Stopka, Marina DiPiazza, Nizhoni Sutter, Thomas W. Gero, Alison Volkert, Lincoln Ombelets, Georgia Dittemore, Matthew G. Rees, Melissa M. Ronan, Jennifer A. Roth, Nathalie Y.R. Agar, David A. Scott, Rosalind A. Segal; A Benzarone Derivative Inhibits EYA to Suppress Tumor Growth in SHH Medulloblastoma. Cancer Res 15 March 2024; 84 (6): 872–886. https://doi.org/10.1158/0008-5472.CAN-22-3784
應用四:FIDA發現小分子互作引起髓鞘堿性蛋白構象改變

圖6.MBP結合后構象變化示意圖
MBP是一種能夠與麥芽糖分子特異性結合的蛋白質,其分子量為42.5 kDa,而麥芽糖的分子量為360 Da。兩者的分子量相差約120倍,結合具有高度的特異性和親和性,FIDA檢測的結合常數(Kd)約為10 µM。當MBP與麥芽糖結合時,MBP從開放構象變為閉合構象,體現出明顯的構象變化。這種變化可以通過FIDA技術進行精確檢測和分析。

圖7.FIDA軟件擬合結果
通過FIDA技術的應用,本研究成功地揭示了麥芽糖分子與麥芽糖結合蛋白(MBP)之間的高親和性相互作用及其引起的構象變化。
應用五:FIDA全自動高通量檢測蛋白聚集體與小分子互作——神經退行性疾病
神經退行性疾病病理標志是錯誤折疊蛋白纖維聚集體的形成。使用示蹤劑進行PET成像檢測患者腦部的蛋白聚集體能夠幫助我們了解、診斷病患的病程進展。然而尋找能夠結合蛋白聚集體的新型小分子面臨著諸多挑戰。傳統的分子互作檢測技術受限于檢測靈敏度、準確性纖維聚集等問題,在神經退行性疾病的研究中存在很多局限性。
在本研究中,研究者篩選了11種小分子化合物和帕金森氏癥(α-syn纖維蛋白)和小分子互作結果,得出了小分子化合物和α-syn纖維蛋白互作導致聚集減少的三種機制。

表1.研究篩選的11種待測化合物

圖8.(a) 在DOPG脂質體和化合物存在下,不同化合物滴定時最大種類的aSO-Alexa488的表觀尺寸(Rh)。Rh的值和種類的百分比可以分別在左y軸和右y軸上讀取。(b) 在化合物滴定下的游離αSO-Alexa488(即不含脂質體)的Rh
圖8中的結果可得出,化合物A1、A2、A3、A4和A6完全阻止了aSO:脂質體復合物的形成,并保留了aSOs的原始大小(~10nm),表明化合物均不和αSO蛋白發生結合,也不減少低聚物產生(圖第8a段)。其余5種化合物(A5、A7、A8、A9和A10)并沒有完全阻止aSO–DOPG復合物的形成。
通過和ELISA數據對比,得出了圖9中化合物和α-syn纖維蛋白互作的三種機制,部分化合物是與膜結合,與α-syn纖維蛋白形成競爭性結合,部分是與蛋白直接結合阻止蛋白聚集,另一部分是與蛋白和膜的復合物結合,減少蛋白對膜穿透性改變。

圖9.化合物與α-syn纖維蛋白互作機制
來源:Somavarapu AK, Kleijwegt G, Nagaraj M, Alam P, Nielsen J, Otzen DE. Drug repurposing screens identify compounds that inhibit α-synuclein oligomers' membrane disruption and block antibody interactions. Chem Sci. 2023;14(11):3030-3047. Published 2023 Feb 21. doi:10.1039/d2sc05534a

FIDA對于小分子和不同蛋白甚至三元復合物的多維表征和對蛋白與核酸互作親和力與動力學的的檢測,是不依賴于分子量變化的,樣本用量少(僅需40nL),甚至不需純化蛋白樣本,由于FIDA自帶粘度補償功能,能確保在任何溶液體系下的有效實驗檢測,是真正的完全不受緩沖液成分影響的多維互作表征技術。并且在每次檢測中都可獲得Rh和熒光強度的正交數據,一次檢測即可對互作結果進行驗證。
FIDA不止提供親和力數據,還能解析互作產生構象變化與結合能變化曲線,讓客戶可以得到全方位解析互作的信息。





