皮質紋狀體谷氨酸介導的電針在帕金森病大鼠模型中的動態治療效果
運動障礙是帕金森病 (PD) 的定義性主要特征,由皮質基底神經節回路功能障礙引起。臨床數據表明,電針 (EA) 刺激可能有益于 PD 患者的運動癥狀,而沒有不良反應。然而,EA 對 PD 的具體影響和潛在機制在很大程度上仍不清楚。
本研究調查了 100 Hz 應用期間和之后 EA 刺激對單側注射 6-羥基多巴胺 (6-OHDA) 創建的 PD 大鼠模型的影響。為了建立 EA 的最佳治療參數,研究員們使用曠場和旋轉測試動態評估運動行為。此外,他們還使用免疫電子顯微鏡評估了皮質紋狀體脊柱的可塑性,并通過微透析、體內電化學和高效液相色譜法測量了多巴胺能和谷氨酸能神經遞質的水平。

本研究通過使用Cerebus在體多通道神經信號采集系統(Blackrock Mircosystems)采集了運動皮層和紋狀體中的局部場電位來記錄神經活動動力學。此外,還采用化學遺傳學技術來探測皮質紋狀體谷氨酸能神經元,并闡明在 PD 大鼠模型中導致 EA 治療益處的機制。
為了檢查 EA 對運動癥狀的影響,研究員們最初評估了 PD 大鼠模型中的運動障礙。2 周后,由 6-OHDA 誘導病變的大鼠在旋轉試驗中表現出運動、行進距離更短和性能受損,表現出明顯的運動障礙。接下來,研究員們研究了不同頻率的 EA 刺激對 6-OHDA 損傷大鼠的影響。

由于紋狀體不僅接受黑質紋狀體 DA能投射,還接受皮質紋狀體和丘腦紋狀體谷氨酸能輸入,研究員們評估了 EA 治療對 DA 耗竭后谷氨酸能投射的影響。為了實現這一目標,他們首先評估了 vGluT1 和 vGluT2 的密度,它們作為投射到紋狀體的皮質和丘腦谷氨酸能軸突末端的標志物。

為了進一步評估 EA 刺激的動態治療效果,研究員們在運動皮層和背外側紋狀體中使用長期植入的電極進行了同步記錄。觀察到DA 耗竭導致在紋狀體和運動皮層中觀察到的高β振蕩幅度顯著升高。皮質紋狀體相干性在高β范圍內也有所增加。

為了實現對抑制皮質紋狀體神經元的選擇性抑制,研究員們在 6-OHDA 損傷大鼠中使用了由設計藥物 (DREADD) hM4Di 獨家激活的抑制性設計受體。進行αCaMKII 和 hM4Di-mCherry 標記的免疫染色以驗證細胞特異性。

為了進一步闡明皮質紋狀體谷氨酸能傳遞對 6-OHDA 病變大鼠 EA 治療效果的貢獻,研究員們試圖通過長期施用 CNO 激活 hM3Dq-DREADD 來抵消 EA 的影響。

越來越多的證據表明,EA 刺激通過多種方法對多巴胺能神經元提供神經保護作用。這些作用包括抗神經炎癥、抗氧化應激和抗凋亡反應,以及調節腸道微生物組。
總之,本文的研究闡明了 PD 中 EA 治療的時間動力學和最佳參數,它強調了抑制皮質紋狀體谷氨酸傳遞在 EA 對 PD 的治療益處中的重要性。
筆名:Liushuai
原文鏈接:https://pmc.ncbi.nlm.nih.gov/articles/PMC11614550/
本研究調查了 100 Hz 應用期間和之后 EA 刺激對單側注射 6-羥基多巴胺 (6-OHDA) 創建的 PD 大鼠模型的影響。為了建立 EA 的最佳治療參數,研究員們使用曠場和旋轉測試動態評估運動行為。此外,他們還使用免疫電子顯微鏡評估了皮質紋狀體脊柱的可塑性,并通過微透析、體內電化學和高效液相色譜法測量了多巴胺能和谷氨酸能神經遞質的水平。

本研究通過使用Cerebus在體多通道神經信號采集系統(Blackrock Mircosystems)采集了運動皮層和紋狀體中的局部場電位來記錄神經活動動力學。此外,還采用化學遺傳學技術來探測皮質紋狀體谷氨酸能神經元,并闡明在 PD 大鼠模型中導致 EA 治療益處的機制。
為了檢查 EA 對運動癥狀的影響,研究員們最初評估了 PD 大鼠模型中的運動障礙。2 周后,由 6-OHDA 誘導病變的大鼠在旋轉試驗中表現出運動、行進距離更短和性能受損,表現出明顯的運動障礙。接下來,研究員們研究了不同頻率的 EA 刺激對 6-OHDA 損傷大鼠的影響。

圖1:電針 (EA) 刺激動態緩解帕金森病大鼠模型中的運動缺陷,
而不影響黑質紋狀體多巴胺功能障礙。
而不影響黑質紋狀體多巴胺功能障礙。
由于紋狀體不僅接受黑質紋狀體 DA能投射,還接受皮質紋狀體和丘腦紋狀體谷氨酸能輸入,研究員們評估了 EA 治療對 DA 耗竭后谷氨酸能投射的影響。為了實現這一目標,他們首先評估了 vGluT1 和 vGluT2 的密度,它們作為投射到紋狀體的皮質和丘腦谷氨酸能軸突末端的標志物。

圖2:電針 (EA) 刺激有效調節皮質紋狀體脊柱可塑性并減輕帕金森病大鼠模型中異常的谷氨酸傳遞。
為了進一步評估 EA 刺激的動態治療效果,研究員們在運動皮層和背外側紋狀體中使用長期植入的電極進行了同步記錄。觀察到DA 耗竭導致在紋狀體和運動皮層中觀察到的高β振蕩幅度顯著升高。皮質紋狀體相干性在高β范圍內也有所增加。

圖3:電針 (EA) 干預動態調節帕金森病大鼠模型中的病理性皮質紋狀體 β 振蕩同步。
為了實現對抑制皮質紋狀體神經元的選擇性抑制,研究員們在 6-OHDA 損傷大鼠中使用了由設計藥物 (DREADD) hM4Di 獨家激活的抑制性設計受體。進行αCaMKII 和 hM4Di-mCherry 標記的免疫染色以驗證細胞特異性。

圖4:皮質紋狀體谷氨酸能神經元的失活減輕了具有 6-羥基多巴胺 (6-OHDA) 病變的大鼠的運動癥狀和高 β 振蕩。
為了進一步闡明皮質紋狀體谷氨酸能傳遞對 6-OHDA 病變大鼠 EA 治療效果的貢獻,研究員們試圖通過長期施用 CNO 激活 hM3Dq-DREADD 來抵消 EA 的影響。

圖5:在 6-羥基多巴胺 (6-OHDA) 引起病變的大鼠中皮質紋狀體神經元的慢性激活中逆轉電針 (EA) 效應。
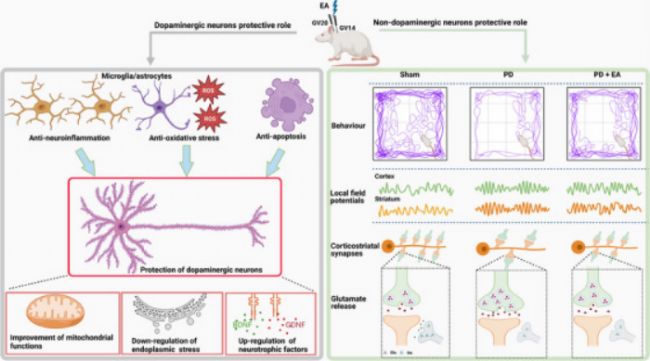
越來越多的證據表明,EA 刺激通過多種方法對多巴胺能神經元提供神經保護作用。這些作用包括抗神經炎癥、抗氧化應激和抗凋亡反應,以及調節腸道微生物組。

圖6:左圖說明了 EA 干預通過各種機制對多巴胺能神經元的神經保護作用,右圖顯示了結果表明,在 PD 大鼠模型中,EA 通過抑制過度的皮質紋狀體谷氨酸傳遞來減輕運動缺陷和同步 β 振蕩。
總之,本文的研究闡明了 PD 中 EA 治療的時間動力學和最佳參數,它強調了抑制皮質紋狀體谷氨酸傳遞在 EA 對 PD 的治療益處中的重要性。
筆名:Liushuai
原文鏈接:https://pmc.ncbi.nlm.nih.gov/articles/PMC11614550/
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





