戊二酸血癥模型Gcdh KO小鼠在罕見代謝疾病研究中的應用
戊二酸血癥I型(GA1),又稱戊二酸尿癥I型,是一種常染色體隱性遺傳的代謝性疾病。2018年,該疾病被列入國家衛健委等五部門聯合制定的《第一批罕見病目錄》。GA1由L-賴氨酸、L-羥基賴氨酸和L-色氨酸的分解代謝缺陷引起,導致代謝產物戊二酸(GA)、3-羥基戊二酸(3-OH-GA)及戊二酰肉堿(C5DC)在體內異常蓄積,進而造成代謝紊亂,主要影響神經系統。GA1的全球發病率約為1/100,000(兒童發病率約為1/30,000至1/100,000)[1],具有種族和地域差異,國內報道約為1/60,000。GA1患兒在正常發育階段后,可能因感染、疫苗接種或手術等誘因觸發急性腦病,導致不可逆的紋狀體損傷,具有較高的致死致殘率。
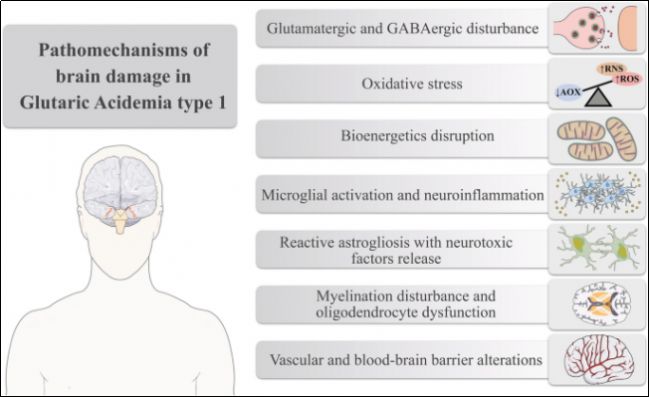
圖1 GA1疾病中腦部損傷的機制 [2]
1.戊二酸血癥I型的發病機制
戊二酰輔酶A脫氫酶(GCDH)是一種線粒體酶,屬于脫氫酶/脫羧酶酶類家族,主要分布于肝臟、腎臟及腦部等代謝活躍組織的線粒體中。GCDH的主要功能是催化戊二酰輔酶A(Glutaryl-CoA, GA-CoA)氧化生成戊烯二酰輔酶A(Glutaconyl-CoA),隨后進一步脫羧為巴豆酰輔酶A(Crotonyl-CoA)。這一過程是賴氨酸、羥基賴氨酸及色氨酸分解代謝的關鍵步驟。由于這些氨基酸是必需氨基酸,其代謝路徑中的中間產物需及時清除,避免在體內蓄積造成毒性。此外,GCDH的功能缺陷會導致某些代謝途徑中斷,影響能量供給,對大腦等高度依賴能量組織的影響尤為明顯。在GCDH缺乏的情況下,戊二酰輔酶A無法正常代謝,導致其轉化為戊二酸(GA)、3-羥基戊二酸(3-OH-GA)及戊二酰肉堿(C5DC)等毒性代謝物。這些代謝物對中樞神經系統具有高度毒性,特別是在紋狀體區域,可能引發神經元損傷、神經元空泡化及炎癥反應 [3-5]。臨床表現包括巨腦癥、進行性肌張力障礙和運動障礙,嚴重者可能致命。

圖2 GA1中的賴氨酸和色氨酸代謝紊亂 [5]
2.Gcdh KO小鼠模型的研究價值
研究表明,Gcdh基因敲除小鼠(Gcdh KO小鼠)展現出與人類GA1疾病高度相似的生化表型,其尿液和腦組織中GA及3-OH-GA水平顯著升高,血清中C5DC含量亦顯著增加,與患者體內水平一致。此外,Gcdh KO小鼠在高蛋白飲食條件下會出現腦病風險、腦空泡形成,并于4~5天內死亡 [7]。高賴氨酸飲食(HLD)進一步加重表型,表現為代謝物積累、紋狀體神經變性和年齡相關腦損傷,斷奶時喂食HLD的小鼠致死率顯著升高。存活至成年期的KO小鼠常伴有嚴重的神經病理學改變,包括神經元缺失、空泡化及腦室內出血 [8-9]。因此,Gcdh KO小鼠被廣泛用于GA1疾病機制研究、治療藥物開發及藥效評估 [10-13]。

圖3 Gcdh KO小鼠用于腺相關病毒(AAV)介導補充療法的臨床前藥效評估 [10]
3.賽業生物Gcdh KO小鼠模型
賽業生物通過敲除Gcdh基因構建了Gcdh KO小鼠(產品編號:C001594)。該模型在血漿、腦部和肝臟組織中均累積了大量的戊二酸(GA),與野生型小鼠相比,呈現出典型的戊二酸血癥I型(GA1)疾病生化表型。該模型是研究GA1發病機制的理想工具,可用于藥物研發、氨基酸代謝及GCDH功能研究。

圖4 野生型小鼠(WT)與Gcdh KO小鼠體內GA水平對比
參考文獻
[1]Li Q, Yang C, Feng L, Zhao Y, Su Y, Liu H, Men H, Huang Y, Körner H, Wang X. Glutaric Acidemia, Pathogenesis and Nutritional Therapy. Front Nutr. 2021 Dec 15;8:704984.
[2]Wajner, M. (2022). Glutaric Acidemia Type 1: An Inherited Neurometabolic Disorder of Intoxication. In: Kostrzewa, R.M. (eds) Handbook of Neurotoxicity. Springer, Cham.
[3]Schuurmans IME, Dimitrov B, Schröter J, Ribes A, de la Fuente RP, Zamora B, van Karnebeek CDM, Kölker S, Garanto A. Exploring genotype-phenotype correlations in glutaric aciduria type 1. J Inherit Metab Dis. 2023 May;46(3):371-390.
[4]Boy N, Mühlhausen C, Maier EM, Ballhausen D, Baumgartner MR, Beblo S, Burgard P, Chapman KA, Dobbelaere D, Heringer-Seifert J, Fleissner S, Grohmann-Held K, Hahn G, Harting I, Hoffmann GF, Jochum F, Karall D, Konstantopoulous V, Krawinkel MB, Lindner M, Märtner EMC, Nuoffer JM, Okun JG, Plecko B, Posset R, Sahm K, Scholl-Bürgi S, Thimm E, Walter M, Williams M, Vom Dahl S, Ziagaki A, Zschocke J, Kölker S. Recommendations for diagnosing and managing individuals with glutaric aciduria type 1: Third revision. J Inherit Metab Dis. 2023 May;46(3):482-519.
[5]Li Q, Yang C, Feng L, Zhao Y, Su Y, Liu H, Men H, Huang Y, Körner H, Wang X. Glutaric Acidemia, Pathogenesis and Nutritional Therapy. Front Nutr. 2021 Dec 15;8:704984.
[6]Koeller DM, Woontner M, Crnic LS, Kleinschmidt-DeMasters B, Stephens J, Hunt EL, Goodman SI. Biochemical, pathologic and behavioral analysis of a mouse model of glutaric acidemia type I. Hum Mol Genet. 2002 Feb 15;11(4):347-57.
[7]Keyser B, Glatzel M, Stellmer F, Kortmann B, Lukacs Z, Kölker S, Sauer SW, Muschol N, Herdering W, Thiem J, Goodman SI, Koeller DM, Ullrich K, Braulke T, Mühlhausen C. Transport and distribution of 3-hydroxyglutaric acid before and during induced encephalopathic crises in a mouse model of glutaric aciduria type 1. Biochim Biophys Acta. 2008 Jun;1782(6):385-90.
[8]Zinnanti WJ, Lazovic J, Wolpert EB, Antonetti DA, Smith MB, Connor JR, Woontner M, Goodman SI, Cheng KC. A diet-induced mouse model for glutaric aciduria type I. Brain. 2006 Apr;129(Pt 4):899-910.
[9]Seminotti B, Amaral AU, da Rosa MS, Fernandes CG, Leipnitz G, Olivera-Bravo S, Barbeito L, Ribeiro CA, de Souza DO, Woontner M, Goodman SI, Koeller DM, Wajner M. Disruption of brain redox homeostasis in glutaryl-CoA dehydrogenase deficient mice treated with high dietary lysine supplementation. Mol Genet Metab. 2013 Jan;108(1):30-9.
[10]Mateu-Bosch A, Segur-Bailach E, Muñoz-Moreno E, Barallobre MJ, Arbonés ML, Gea-Sorlí S, Tort F, Ribes A, García-Villoria J, Fillat C. Systemic delivery of AAV-GCDH ameliorates HLD-induced phenotype in a glutaric aciduria type I mouse model. Mol Ther Methods Clin Dev. 2024 Jun 4;32(3):101276.
[11]Barzi M, Johnson CG, Chen T, Rodriguiz RM, Hemmingsen M, Gonzalez TJ, Rosales A, Beasley J, Peck CK, Ma Y, Stiles AR, Wood TC, Maeso-Diaz R, Diehl AM, Young SP, Everitt JI, Wetsel WC, Lagor WR, Bissig-Choisat B, Asokan A, El-Gharbawy A, Bissig KD. Rescue of glutaric aciduria type I in mice by liver-directed therapies. Sci Transl Med. 2023 Apr 19;15(692):eadf4086.
[12]Wagner GR, Bhatt DP, O'Connell TM, Thompson JW, Dubois LG, Backos DS, Yang H, Mitchell GA, Ilkayeva OR, Stevens RD, Grimsrud PA, Hirschey MD. A Class of Reactive Acyl-CoA Species Reveals the Non-enzymatic Origins of Protein Acylation. Cell Metab. 2017 Apr 4;25(4):823-837.e8.
[13]Sauer SW, Opp S, Komatsuzaki S, Blank AE, Mittelbronn M, Burgard P, Koeller DM, Okun JG, Kölker S. Multifactorial modulation of susceptibility to l-lysine in an animal model of glutaric aciduria type I. Biochim Biophys Acta. 2015 May;1852(5):768-77.