從細(xì)胞殺手到免疫激活:ADC有效載荷的三代進(jìn)化與未來(lái)突破
在抗體偶聯(lián)藥物(ADC)的精準(zhǔn)抗癌體系中,有效載荷(payload)如同導(dǎo)彈的 “彈頭”,其殺傷力與特異性直接決定治療效果。從最初借用化療藥物的 “粗放攻擊”,到如今聚焦 DNA 損傷劑與免疫調(diào)節(jié)劑的 “智能制導(dǎo)”,有效載荷歷經(jīng)三代技術(shù)革新,正從單一細(xì)胞毒性分子升級(jí)為融合多重機(jī)制的 “多功能武器”。本文將從作用機(jī)制、創(chuàng)新路徑與未來(lái)方向,解析這一核心組件如何重塑 ADC 藥物的抗癌格局。
一、有效載荷的 “理想武器” 畫像:精準(zhǔn)殺傷的六大黃金準(zhǔn)則
理想的有效載荷需兼具 “殺手本能” 與 “精準(zhǔn)特質(zhì)”:
1. 第一代:化療藥物的 “跨界試水”
早期 ADC 直接借用經(jīng)典化療藥如甲氨蝶呤、阿霉素,雖實(shí)現(xiàn)靶向遞送,但毒性不足、耐藥性強(qiáng)的缺陷顯著。例如阿霉素類 ADC 因 payload 水溶性差、旁觀者效應(yīng)弱,臨床效果有限,促使研發(fā)轉(zhuǎn)向更高效的分子。
2. 第二代:微管抑制劑的 “精準(zhǔn)絞殺”
以美登素(Maytansinoids)和奧瑞他汀(Auristatins)為代表,通過(guò)阻斷微管聚合或穩(wěn)定微管結(jié)構(gòu),將癌細(xì)胞阻滯在 G2/M 期:
3. 第三代:DNA 損傷劑的 “基因組爆破”
轉(zhuǎn)向靶向 DNA 的載荷,通過(guò)雙鏈斷裂、烷基化等機(jī)制引發(fā)不可逆損傷:
三、多元化創(chuàng)新:從 “單一殺傷” 到 “機(jī)制跨界”
1. 靶向 RNA:狙擊休眠癌細(xì)胞的 “沉默殺手”
針對(duì) RNA 的載荷可攻擊分裂期與休眠期細(xì)胞:
2. 免疫激活:改寫腫瘤微環(huán)境的 “雙向武器”
免疫類 ADC(ISACs)跳出直接殺傷模式,通過(guò)激活免疫系統(tǒng)實(shí)現(xiàn) “雙重打擊”:
3. 新型潛力:突破傳統(tǒng)框架的 “未來(lái)之星”
四、未來(lái)方向:從 “單一彈頭” 到 “智能武器庫(kù)”
1. 雙載荷 ADC:同時(shí)搭載微管抑制劑與 DNA 損傷劑,協(xié)同攻擊多條通路,降低耐藥風(fēng)險(xiǎn);
2. 個(gè)性化定制:基于腫瘤基因組特征設(shè)計(jì)載荷,如針對(duì) BRCA 突變腫瘤的 PARP 抑制劑載荷;
3. 多學(xué)科融合:結(jié)合 AI 藥物設(shè)計(jì)優(yōu)化載荷結(jié)構(gòu),利用基因編輯技術(shù)開發(fā)腫瘤特異性靶點(diǎn)偶聯(lián)物;
4. 毒性精準(zhǔn)調(diào)控:通過(guò)可裂解連接子與 pH 響應(yīng)釋放,平衡療效與安全性,如改善卡奇霉素的正常組織毒性。
有效載荷 ——ADC 變革的 “引擎核心”
從天然產(chǎn)物提取到全合成創(chuàng)新,從細(xì)胞毒性分子到免疫調(diào)節(jié)劑,有效載荷的進(jìn)化史就是 ADC 藥物的 “戰(zhàn)斗力升級(jí)史”。當(dāng)靶向微管的 “細(xì)胞分裂終結(jié)者”、靶向 DNA 的 “基因組爆破手” 與激活免疫的 “微環(huán)境重塑者” 協(xié)同發(fā)力,ADC 正從 “精準(zhǔn)打擊” 邁向 “系統(tǒng)瓦解”。未來(lái),隨著雙載荷、PROTAC 等新技術(shù)的落地,有效載荷將成為連接靶向治療、免疫治療與基因治療的核心樞紐,推動(dòng)癌癥治療進(jìn)入 “個(gè)性化精準(zhǔn)制導(dǎo)” 的全新時(shí)代。每一次載荷創(chuàng)新,都是向 “治愈癌癥” 目標(biāo)發(fā)射的一枚新 “彈頭”,而這場(chǎng)持續(xù)升級(jí)的 “武器革命”,終將改寫腫瘤治療的未來(lái)格局。
產(chǎn)品信息
杭州斯達(dá)特 (www.starter-bio.com)志在為全球生命科學(xué)行業(yè)提供優(yōu)質(zhì)的抗體、蛋白、試劑盒等產(chǎn)品及研發(fā)服務(wù)。依托多個(gè)開發(fā)平臺(tái):重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發(fā)平臺(tái)(E.coli,CHO,HEK293,InsectCells),已正式通過(guò)歐盟98/79/EC認(rèn)證、ISO9001認(rèn)證、ISO13485。
一、有效載荷的 “理想武器” 畫像:精準(zhǔn)殺傷的六大黃金準(zhǔn)則
理想的有效載荷需兼具 “殺手本能” 與 “精準(zhǔn)特質(zhì)”:
- 極致毒性:皮摩爾級(jí)(pM)細(xì)胞毒性,確保少量分子即可誘導(dǎo)癌細(xì)胞凋亡;
- 低免疫原性:避免引發(fā)抗體反應(yīng),延長(zhǎng)藥物循環(huán)時(shí)間;
- 穩(wěn)定性優(yōu)勢(shì):在血液中保持結(jié)構(gòu)完整,抵達(dá)腫瘤后響應(yīng)微環(huán)境釋放;
- 可修飾性:預(yù)留偶聯(lián)位點(diǎn),不影響藥效的同時(shí)兼容連接子設(shè)計(jì);
- 旁觀者效應(yīng):殺傷鄰近未表達(dá)抗原的癌細(xì)胞,應(yīng)對(duì)腫瘤異質(zhì)性;
- 胞內(nèi)靶向:作用靶點(diǎn)位于細(xì)胞內(nèi),規(guī)避細(xì)胞外環(huán)境干擾。
這些特性如同 “武器驗(yàn)收標(biāo)準(zhǔn)”,驅(qū)動(dòng)有效載荷從天然產(chǎn)物改造走向全合成創(chuàng)新。
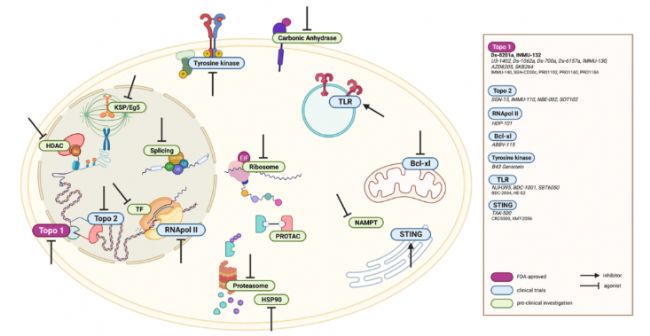
微管和DNA烷化劑以外的ADC有效載荷示意圖
1. 第一代:化療藥物的 “跨界試水”
早期 ADC 直接借用經(jīng)典化療藥如甲氨蝶呤、阿霉素,雖實(shí)現(xiàn)靶向遞送,但毒性不足、耐藥性強(qiáng)的缺陷顯著。例如阿霉素類 ADC 因 payload 水溶性差、旁觀者效應(yīng)弱,臨床效果有限,促使研發(fā)轉(zhuǎn)向更高效的分子。
2. 第二代:微管抑制劑的 “精準(zhǔn)絞殺”
以美登素(Maytansinoids)和奧瑞他汀(Auristatins)為代表,通過(guò)阻斷微管聚合或穩(wěn)定微管結(jié)構(gòu),將癌細(xì)胞阻滯在 G2/M 期:
- 美登素衍生物 DM1/DM4:源自非洲灌木的天然產(chǎn)物,經(jīng) C3 側(cè)鏈修飾獲得偶聯(lián)位點(diǎn),成為曲妥珠單抗 ADC(T-DM1)的核心載荷,開創(chuàng) HER2 陽(yáng)性乳腺癌治療新范式;
- 奧瑞他汀 MMAE/MMAF:海兔毒素合成類似物,四肽結(jié)構(gòu)賦予高膜滲透性,介導(dǎo)的旁觀者效應(yīng)顯著增強(qiáng)實(shí)體瘤殺傷,支撐帕妥珠單抗等 ADC 的臨床成功。
這類載荷的 IC50 低至納摩爾級(jí)(nM),但對(duì)分裂期細(xì)胞的選擇性限制了對(duì)休眠腫瘤細(xì)胞的作用。
3. 第三代:DNA 損傷劑的 “基因組爆破”
轉(zhuǎn)向靶向 DNA 的載荷,通過(guò)雙鏈斷裂、烷基化等機(jī)制引發(fā)不可逆損傷:
- 烯二炔類卡奇霉素:自然界最強(qiáng)細(xì)胞毒素之一,誘導(dǎo) DNA 雙鏈斷裂效率比化療藥高 100 倍,支撐 Mylotarg 治療急性髓系白血病;
- 拓?fù)洚悩?gòu)酶 I 抑制劑 DXd:喜樹堿衍生物,克服傳統(tǒng)藥物水溶性差問題,在 T-DXd 中展現(xiàn) “旁觀者效應(yīng)” 優(yōu)勢(shì),對(duì) HER2 低表達(dá)乳腺癌客觀緩解率達(dá) 60%;
- PBD 二聚體:選擇性烷基化 DNA 小溝,單藥即可引發(fā)凋亡,成為下一代高特異性載荷候選。
這類載荷作用于全細(xì)胞周期,對(duì)低抗原表達(dá)腫瘤仍有效,突破第二代的靶點(diǎn)限制。
三、多元化創(chuàng)新:從 “單一殺傷” 到 “機(jī)制跨界”
1. 靶向 RNA:狙擊休眠癌細(xì)胞的 “沉默殺手”
針對(duì) RNA 的載荷可攻擊分裂期與休眠期細(xì)胞:
- 泰蘭斯他汀:抑制 mRNA 剪接體,阻斷癌細(xì)胞基因表達(dá),輝瑞將其與曲妥珠單抗偶聯(lián),體外試驗(yàn)顯示對(duì)耐藥細(xì)胞株的高效清除;
- 毒傘肽:抑制 RNA 聚合酶 II,水溶性環(huán)狀八肽結(jié)構(gòu)賦予穩(wěn)定性,HDP-101 靶向 BCMA 治療多發(fā)性骨髓瘤,臨床試驗(yàn)顯示深度緩解潛力。
2. 免疫激活:改寫腫瘤微環(huán)境的 “雙向武器”
免疫類 ADC(ISACs)跳出直接殺傷模式,通過(guò)激活免疫系統(tǒng)實(shí)現(xiàn) “雙重打擊”:
- TLR 激動(dòng)劑:如 TLR7/8 激動(dòng)劑與抗 Her2 抗體偶聯(lián),驅(qū)動(dòng)樹突狀細(xì)胞成熟和 CD8+T 細(xì)胞募集,將 “冷腫瘤” 轉(zhuǎn)化為 “熱腫瘤”,恒瑞、百濟(jì)等藥企已布局相關(guān)管線;
- STING 激動(dòng)劑:環(huán)二核苷酸(CDN)偶聯(lián)抗體靶向遞送,激活 I 型干擾素通路,Mersana 的 XMT-2056 獲 FDA 孤兒藥認(rèn)定,針對(duì)胃癌的臨床前數(shù)據(jù)顯示腫瘤微環(huán)境顯著重塑。
3. 新型潛力:突破傳統(tǒng)框架的 “未來(lái)之星”
- Bcl-xL 抑制劑:阻斷抗凋亡蛋白,誘導(dǎo)癌細(xì)胞程序性死亡,AbbVie 的 ABBV-155 靶向 EGFR,降低對(duì)血小板毒性,臨床研究中展現(xiàn)對(duì)實(shí)體瘤的抑制潛力;
- PROTAC 分子:利用蛋白酶體降解機(jī)制,為 ADC 引入 “蛋白降解” 新功能,解決傳統(tǒng)載荷耐藥問題;
- 近紅外光免疫療法:IR700DX 等光敏劑作為載荷,光照觸發(fā)腫瘤血管破壞,開創(chuàng) “光控精準(zhǔn)殺傷” 新領(lǐng)域。
四、未來(lái)方向:從 “單一彈頭” 到 “智能武器庫(kù)”
1. 雙載荷 ADC:同時(shí)搭載微管抑制劑與 DNA 損傷劑,協(xié)同攻擊多條通路,降低耐藥風(fēng)險(xiǎn);
2. 個(gè)性化定制:基于腫瘤基因組特征設(shè)計(jì)載荷,如針對(duì) BRCA 突變腫瘤的 PARP 抑制劑載荷;
3. 多學(xué)科融合:結(jié)合 AI 藥物設(shè)計(jì)優(yōu)化載荷結(jié)構(gòu),利用基因編輯技術(shù)開發(fā)腫瘤特異性靶點(diǎn)偶聯(lián)物;
4. 毒性精準(zhǔn)調(diào)控:通過(guò)可裂解連接子與 pH 響應(yīng)釋放,平衡療效與安全性,如改善卡奇霉素的正常組織毒性。
有效載荷 ——ADC 變革的 “引擎核心”
從天然產(chǎn)物提取到全合成創(chuàng)新,從細(xì)胞毒性分子到免疫調(diào)節(jié)劑,有效載荷的進(jìn)化史就是 ADC 藥物的 “戰(zhàn)斗力升級(jí)史”。當(dāng)靶向微管的 “細(xì)胞分裂終結(jié)者”、靶向 DNA 的 “基因組爆破手” 與激活免疫的 “微環(huán)境重塑者” 協(xié)同發(fā)力,ADC 正從 “精準(zhǔn)打擊” 邁向 “系統(tǒng)瓦解”。未來(lái),隨著雙載荷、PROTAC 等新技術(shù)的落地,有效載荷將成為連接靶向治療、免疫治療與基因治療的核心樞紐,推動(dòng)癌癥治療進(jìn)入 “個(gè)性化精準(zhǔn)制導(dǎo)” 的全新時(shí)代。每一次載荷創(chuàng)新,都是向 “治愈癌癥” 目標(biāo)發(fā)射的一枚新 “彈頭”,而這場(chǎng)持續(xù)升級(jí)的 “武器革命”,終將改寫腫瘤治療的未來(lái)格局。
產(chǎn)品信息

杭州斯達(dá)特 (www.starter-bio.com)志在為全球生命科學(xué)行業(yè)提供優(yōu)質(zhì)的抗體、蛋白、試劑盒等產(chǎn)品及研發(fā)服務(wù)。依托多個(gè)開發(fā)平臺(tái):重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發(fā)平臺(tái)(E.coli,CHO,HEK293,InsectCells),已正式通過(guò)歐盟98/79/EC認(rèn)證、ISO9001認(rèn)證、ISO13485。
- 從細(xì)胞殺手到免疫激活:ADC有效載荷的三代進(jìn)化與未來(lái)突破
- ADC藥物新型有效載荷的的抗癌機(jī)制
- Flag標(biāo)簽及其特異性抗體在蛋白研究中的技術(shù)優(yōu)勢(shì)
- 抗體偶聯(lián)藥物(ADC)藥物有效載荷的作用機(jī)制及在癌癥治療中的應(yīng)用前景
- 基于乳酸化修飾的肝纖維化作用機(jī)制解析
- β-Catenin(β-連環(huán)蛋白)結(jié)構(gòu)特征、生物學(xué)功能及在疾病中的作用機(jī)制
- PI3K-Akt信號(hào)通路助力解碼癌細(xì)胞的生存引擎與靶向治療新方向
- 蛋白乙酰化研究全攻略:從修飾發(fā)現(xiàn)到功能解析的完整路徑
- 斯達(dá)特生物將亮相2025年美國(guó)AACR展會(huì),誠(chéng)邀您蒞臨!
- MCE直播預(yù)告:銅死亡的機(jī)制探索與醫(yī)學(xué)應(yīng)用
- 2024第九屆疫苗中國(guó)領(lǐng)導(dǎo)者年會(huì)通知
- MCE推出超900種一抗和多種二抗產(chǎn)品,涵蓋熱門靶點(diǎn)
- 丹納赫將收購(gòu)Abcam以推動(dòng)生命科學(xué)領(lǐng)域研究創(chuàng)新進(jìn)程
- 睿捷生物新學(xué)期新福利,四重優(yōu)惠限時(shí)享
- 佰諾全景科研mIHC病理技術(shù)服務(wù)年中大促銷火熱來(lái)襲
- 西美杰KPL熱銷二抗和底物限時(shí)優(yōu)惠活動(dòng)已啟動(dòng)!
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





