【干貨】萬里挑到一,藥效學研究在藥物上市前做了什么?
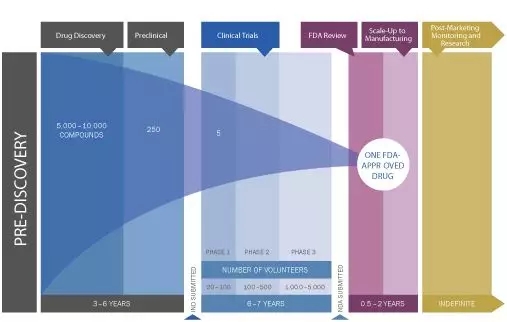
新藥從設計到上市通常需要10-15年的時間,經歷漫長的研發過程和層層考驗,同時需要大量的資本投入。藥物通過發現篩選、臨床前研究、臨床試驗、新藥NMPA/FDA上市申報等環節,最終成為穩定、安全、有效的藥品,惠及人類健康。其中的每個研究階段都至關重要,特別是臨床前藥物研究獲得的結果對藥物進入臨床提供關鍵的數據指導,為優化臨床開發計劃提供有力的數據基礎。
臨床前研究涵蓋藥效學研究、藥代動力學研究、藥理學評價、毒理安全性評價等。
藥效學研究是藥物評估的前提基礎,用于:確定受試藥物有無療效、鑒別合適的有效及安全劑量方案、闡明受試藥物的作用特點、揭示可能的作用機制、藥物濃度與藥理作用/副作用間的關系;也可以補足指導臨床用藥,必要時證明藥物聯合應用的合理性[2-3]。
藥效學研究數據在申報的材料準備中,其重要性往往被忽視,大家似乎更關注毒理安全性評價等環節,其原因在于多數風險由申報企業自己承擔,實際上臨床前體內、體外的藥效學除了能為臨床給藥提供必須的指導外,其研究結果準確性也是一個新藥是否能夠成功上市,能否收回成本獲取利潤的關鍵!
藥效學研究主要實驗內容包括:體外試驗(生化試驗、細胞試驗等)和體內試驗(整體動物實驗)。
體內藥效試驗涉及:
1、動物模型選擇:要考慮與臨床相關性:動物敏感性,疾病模型發病機制等。
2、藥物劑量設置:參考體外試驗結果,同類藥物有效劑量,預實驗結果等設置給藥劑量,開始給藥時間、給藥間隔時間。能否獲得有效劑量范圍,包括起始劑量、最佳有效劑量和量效關系是判斷劑量設置合理與否的標準。
3、給藥途徑選擇:與臨床擬給藥方式一致,不同的給藥途徑獲得的藥效結果也會不同。根據文獻及實際體內試驗發現聯合用藥的給藥先后順序對結果也有重要影響,體外試驗無法完全顯示。
4、相關考察指標:主要藥效學指標(抑瘤率,半數有效量等),次要藥效學指標;提示作用機制的指標(藥物靶分子表達水平等)等的考察。
動物模型選擇是體內藥效研究的關鍵。一般選擇動物模型進行體內藥效需要注意兩點:一是動物模型跟人體的相似性,即動物可以有效模擬人體疾病;二是藥物作用機制在動物中的有效性,藥物在動物模型中的可以有成功發揮藥效的機制。
正如ICH指導原則中提到:“許多生物技術藥物的生物學活性具有種屬特異性,選擇相關動物種屬進行試驗非常重要。相關動物種屬是指受試物在此類動物上受體或抗原表位有表達,能夠產生藥理活性,其對生物制品的生物學反應能模擬人體反應。”[4-5]
近年來,與人類疾病相似的動物模型開發取得很大的發展,包括誘發的和自發的疾病模型、基因改造動物。這些模型可對藥物做出藥效評估和劑量選擇,也有助于確定藥物安全性。
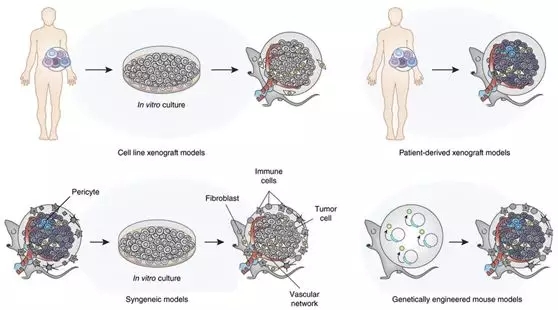
Preclinical in vivo efficacy models for oncology drug discovery[6]
對于腫瘤免疫領域,新型抗體腫瘤免疫藥物的出現,對動物模型提出了更高的要求,而基因編輯人源化小鼠將小鼠的免疫檢查點等靶點基因進行人源化改造,也可將接種改造的腫瘤細胞系進行個別基因的人源化改造,可以更加貼近真實的人類腫瘤治療作用機制,有效地篩選和評價人源腫瘤免疫抗體藥物,由于其獨有的優勢也越來越獲得大范圍的使用和認可。基于重度免疫缺陷小鼠(比如 JAX NSG小鼠,百奧賽圖B-NDG小鼠)的免疫重建系統模型、PDX模型可以接種人源的腫瘤,保留了腫瘤的細胞和遺傳特征,也是很好的評價藥物的動物模型,但其批間差異比較大,獲得藥物評價所需的大批量穩定可重復的模型還需要更多的探索和開發。
參考資料:
[1]http://blogs.nature.com/news/2012/09/pharma-comes-together-over-clinical-trials.html
[2]Haughey D.B., Jardieu P.M. (2004) The Pharmacokinetics and Pharmacodynamics of Monoclonal Antibodies. In: Subramanian G. (eds) Antibodies.
[3] Lobo, E. D., Hansen, R. J., & Balthasar, J. P. (2004). Antibody Pharmacokinetics and Pharmacodynamics. Journal of Pharmaceutical Sciences, 93(11), 2645–2668.
[4] 治療用生物制品非臨床安全性技術審評一般原則(2010)藥品審評中心
[5] ICH指導原則:生物技術藥物臨床前安全性評價(S6 R1)
[6] Gould, S. E., Junttila, M. R., & de Sauvage, F. J. (2015). Translational value of mouse models in oncology drug development. Nature Medicine, 21(5), 431–439.

Drug discovery and development[1]
臨床前研究-藥效學研究
臨床前研究涵蓋藥效學研究、藥代動力學研究、藥理學評價、毒理安全性評價等。
藥效學研究是藥物評估的前提基礎,用于:確定受試藥物有無療效、鑒別合適的有效及安全劑量方案、闡明受試藥物的作用特點、揭示可能的作用機制、藥物濃度與藥理作用/副作用間的關系;也可以補足指導臨床用藥,必要時證明藥物聯合應用的合理性[2-3]。
藥效學研究數據在申報的材料準備中,其重要性往往被忽視,大家似乎更關注毒理安全性評價等環節,其原因在于多數風險由申報企業自己承擔,實際上臨床前體內、體外的藥效學除了能為臨床給藥提供必須的指導外,其研究結果準確性也是一個新藥是否能夠成功上市,能否收回成本獲取利潤的關鍵!
藥效學研究主要實驗內容包括:體外試驗(生化試驗、細胞試驗等)和體內試驗(整體動物實驗)。
體內藥效試驗涉及:
1、動物模型選擇:要考慮與臨床相關性:動物敏感性,疾病模型發病機制等。
2、藥物劑量設置:參考體外試驗結果,同類藥物有效劑量,預實驗結果等設置給藥劑量,開始給藥時間、給藥間隔時間。能否獲得有效劑量范圍,包括起始劑量、最佳有效劑量和量效關系是判斷劑量設置合理與否的標準。
3、給藥途徑選擇:與臨床擬給藥方式一致,不同的給藥途徑獲得的藥效結果也會不同。根據文獻及實際體內試驗發現聯合用藥的給藥先后順序對結果也有重要影響,體外試驗無法完全顯示。
4、相關考察指標:主要藥效學指標(抑瘤率,半數有效量等),次要藥效學指標;提示作用機制的指標(藥物靶分子表達水平等)等的考察。
體內藥效動物模型選擇
動物模型選擇是體內藥效研究的關鍵。一般選擇動物模型進行體內藥效需要注意兩點:一是動物模型跟人體的相似性,即動物可以有效模擬人體疾病;二是藥物作用機制在動物中的有效性,藥物在動物模型中的可以有成功發揮藥效的機制。
正如ICH指導原則中提到:“許多生物技術藥物的生物學活性具有種屬特異性,選擇相關動物種屬進行試驗非常重要。相關動物種屬是指受試物在此類動物上受體或抗原表位有表達,能夠產生藥理活性,其對生物制品的生物學反應能模擬人體反應。”[4-5]
近年來,與人類疾病相似的動物模型開發取得很大的發展,包括誘發的和自發的疾病模型、基因改造動物。這些模型可對藥物做出藥效評估和劑量選擇,也有助于確定藥物安全性。

Preclinical in vivo efficacy models for oncology drug discovery[6]
對于腫瘤免疫領域,新型抗體腫瘤免疫藥物的出現,對動物模型提出了更高的要求,而基因編輯人源化小鼠將小鼠的免疫檢查點等靶點基因進行人源化改造,也可將接種改造的腫瘤細胞系進行個別基因的人源化改造,可以更加貼近真實的人類腫瘤治療作用機制,有效地篩選和評價人源腫瘤免疫抗體藥物,由于其獨有的優勢也越來越獲得大范圍的使用和認可。基于重度免疫缺陷小鼠(比如 JAX NSG小鼠,百奧賽圖B-NDG小鼠)的免疫重建系統模型、PDX模型可以接種人源的腫瘤,保留了腫瘤的細胞和遺傳特征,也是很好的評價藥物的動物模型,但其批間差異比較大,獲得藥物評價所需的大批量穩定可重復的模型還需要更多的探索和開發。
參考資料:
[1]http://blogs.nature.com/news/2012/09/pharma-comes-together-over-clinical-trials.html
[2]Haughey D.B., Jardieu P.M. (2004) The Pharmacokinetics and Pharmacodynamics of Monoclonal Antibodies. In: Subramanian G. (eds) Antibodies.
[3] Lobo, E. D., Hansen, R. J., & Balthasar, J. P. (2004). Antibody Pharmacokinetics and Pharmacodynamics. Journal of Pharmaceutical Sciences, 93(11), 2645–2668.
[4] 治療用生物制品非臨床安全性技術審評一般原則(2010)藥品審評中心
[5] ICH指導原則:生物技術藥物臨床前安全性評價(S6 R1)
[6] Gould, S. E., Junttila, M. R., & de Sauvage, F. J. (2015). Translational value of mouse models in oncology drug development. Nature Medicine, 21(5), 431–439.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





