層析填料壽命研究的法規要求、影響因素及研究策略
層析工藝已日漸成為生物制品生產工藝中不可或缺的工藝步驟。通常,一個生產工藝需要設計多個正交的層析步驟來達到較高的目標純度水平,最大限度地減少殘留雜質水平,并滿足與外源性物質有關的安全標準。
工藝的操作成本很大程度上是由層析填料的成本驅動的,因此層析填料可使用的批次或循環次數(層析填料壽命)對生產成本的控制至關重要。
各國監管部門出于對藥品安全性和有效性的考量,其法規文件明確規定了對“層析填料的使用壽命及可接受限度”的要求。
Table 1. 層析填料壽命研究的法規指南要求

此外,2021年,PDA發布了技術報告60-3《工藝驗證:生命周期方法 附件2:生物制藥原料藥生產》,報告中明確提出提高層析介質的相關驗證是工藝驗證的重要部分。
層析填料在使用過程中,會有很多影響其壽命的因素,主要包括以下幾點:
(1) 該步驟在純化工藝中的位置和來料的性質。(一般而言,捕獲粗純階段填料壽命衰減得更快,精純階段填料壽命衰減得慢)
(2) 層析填料的再生、清潔和保存程序。
(3) 層析柱裝填和損耗。
層析填料壽命研究策略必須能夠完全反映商業化生產規模的性能,或者必須能體現與商業化生產規模之間的相關性。
Table 2. 層析填料壽命研究策略

注:監控頻率(N)可根據對工藝的理解和實際情況做適應性調整。
• 縮小模型(Scale Down)壽命驗證前瞻性研究需要使用縮小模型來進行。該縮小模型采用線性縮小的原則,即維持柱床高度、線性流速、上樣載量(可采用最差條件)、緩沖液用量(CV)和洗脫收集標準不變,縮小層析柱的柱直徑、體積流速和樣品體積,同時關注層析柱壓力、樣品擴散、系統死體積和柱效等因素。
一般可使用工藝表征期間建立和確認的縮小模型,因為已經確認了它可以代表商業化規模的工藝。
• 空白運行(Carryover)層析填料壽命研究的實驗設計需要考慮空白運行(Carryover)。周期性地進行空白運行可以用于評估清潔程序效果和產品殘留程度。在空白運行中,層析柱按照常規的步驟操作,不同之處在于,用水或者緩沖液代替來料上樣。
層析介質的使用壽命根據檢測指標的標準來定義。檢測指標的標準可以設定為一個具體的截止標準,比如收率>80%,SEC-HPLC 純度>95%等,也可以通過檢測循環次數間的一致性來定義,此時就不再設置具體數值標準。
Table 3. 壽命研究的評價指標及其可接受標準(舉例)

層析填料壽命研究的終點判定可以選擇達到檢測標準的循環次數數值,或者出現批間異常的循環次數數值。通常較為保守的做法是將確定的循環次數數值乘以一個安全系數,來定義最終的層析填料壽命次數。
Novo-A Diamond親和填料是博格隆自主研發的新一代高耐堿Protein A抗體親和填料,可耐受0.5M~1.0M NaOH進行CIP,填料的載量更高、壓力流速性能更好。
本案例使用含有單克隆抗體的細胞培養上清,對Novo-A Diamond親和填料進行了188個循環的測試,用0.1M NaOH和0.5M NaOH進行CIP,同時檢測洗脫收率、HCP、HCD、Protein A、SEC指標。
測試數據表明Novo-A Diamond具有較高的載量(初始10%DBC為67 mg/mL),運行156個循壞后依然高于初始10%DBC的80%;所有循環的收率穩定,洗脫樣品純度穩定,HCP、HCD和蛋白A的殘留始終處于較低的水平。
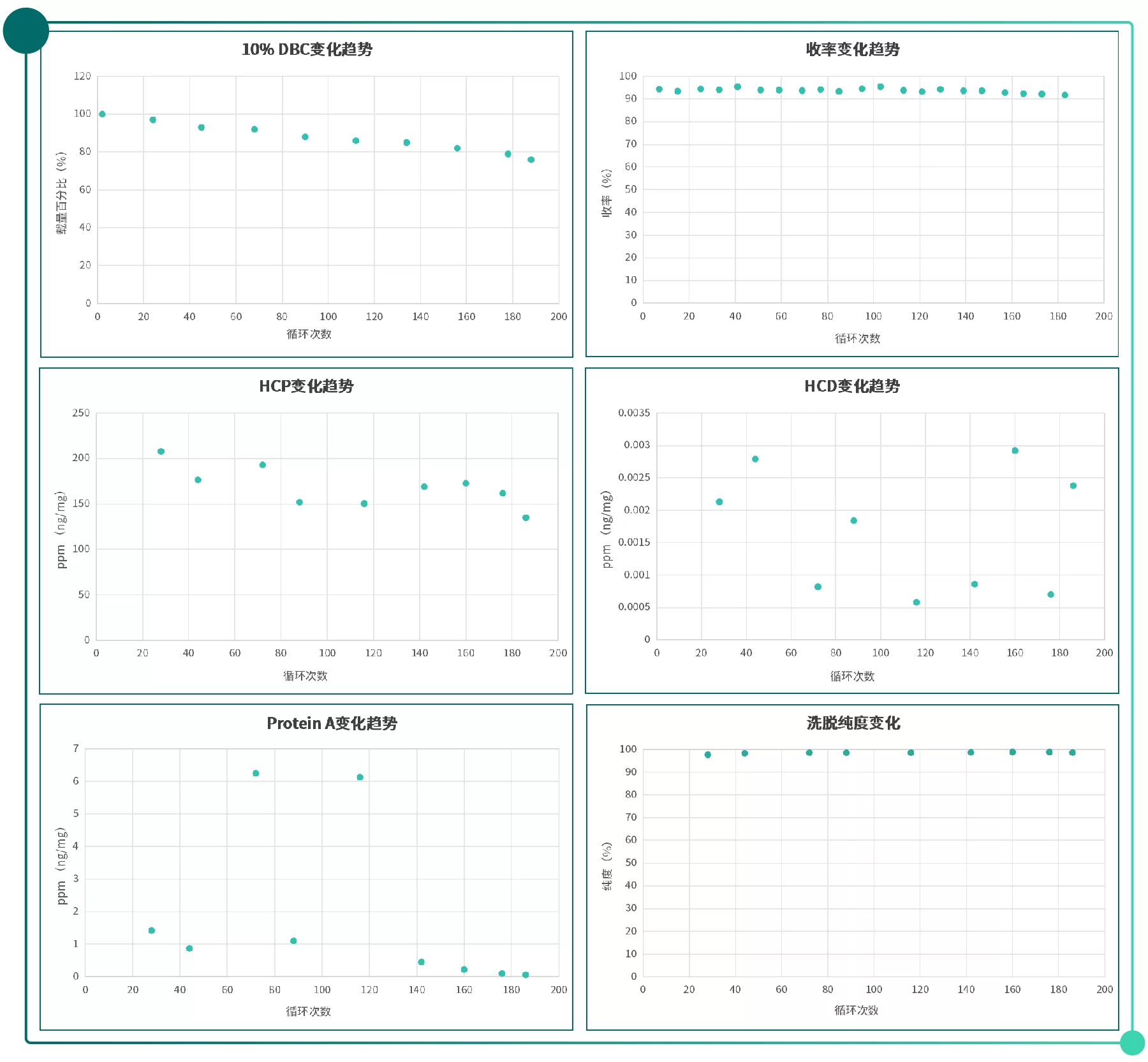
Fig.1 Novo-A Diamond 壽命研究各項數據檢測結果圖譜
層析填料作為生物制藥下游純化工藝中至關重要的原材料,其性能與生物藥物的產品質量密切相關。通過填料壽命研究實驗,不僅僅提高了生產工藝的可控性與經濟性,也為商業化生產提供可靠保證。
參考資料
[1] 2020 版《中國藥典》三部“人用重組單克隆抗體制品總論”.
[2] FDA “Guidance for Industry:Process Validation: General Principles and Practices”.
[3] FDA “Points to Consider in the Manufacture and Testing ofMonoclonal Antibody Products for Human Use”.
[4] EMA “Guideline on process validation for the manufacture of biotechnology-derived active substances and data to be provided in the regulatory submission”.
[5] EMA “CPMP Position Statement on DNA and Host Cell Proteins (HCP) Impurities, Routine Testing Versus Validation Studies,” CPMP/BWP/382/97.
[6] PDA Technical Report No.60-3: Process validation: A lifecycle approach Annex 2: biopharmaceutical drug substances manufacturing. Parenteral Drug Association: 2021.