單細胞空間轉(zhuǎn)錄組技術(shù)助力發(fā)現(xiàn)腫瘤癌前病變關(guān)鍵細胞生態(tài)位
食管癌是中國人群高發(fā)的惡性腫瘤,每年新發(fā)病例占全球的53% ,5年生存率不到30%,嚴(yán)重危害人民生命健康。中國患者以食管鱗癌為主,而歐美以食管腺癌為主,兩者在發(fā)病原因和疾病診治上存在顯著差異。多年的流行病學(xué)研究表明,我國食管癌死亡率居高不下的主要原因是患者在早期沒有被發(fā)現(xiàn),臨床就診時患往往已到了中晚期,導(dǎo)致平均生存時間不到8個月,5年生存率不足5%。如果能做到早發(fā)現(xiàn),癌患者的5年生存率可達90%以上。因此,如何早發(fā)現(xiàn)、早診斷、早治療,對降低食管癌發(fā)病率和死亡率至關(guān)重要。
癌變是一個漫長的過程,需經(jīng)歷從正常→癌前病變→浸潤癌的惡性演進過程。癌前病變是癌變的關(guān)鍵階段,這方面的檢查、治療技術(shù)都非常成熟,如果能在早期發(fā)現(xiàn)食管癌前病變并進行胃鏡下粘膜切除治療,就可有效阻止其發(fā)展到晚期癌,達到臨床治愈。因此,全方位系統(tǒng)性揭示和刻畫癌前病變時空演進過程,揭示上皮細胞與其微環(huán)境的交互作用,探索腫瘤形成的動態(tài)分子路徑,進而發(fā)現(xiàn)潛在的預(yù)防性干預(yù)靶點和早診標(biāo)志物,成為關(guān)鍵的科學(xué)問題。
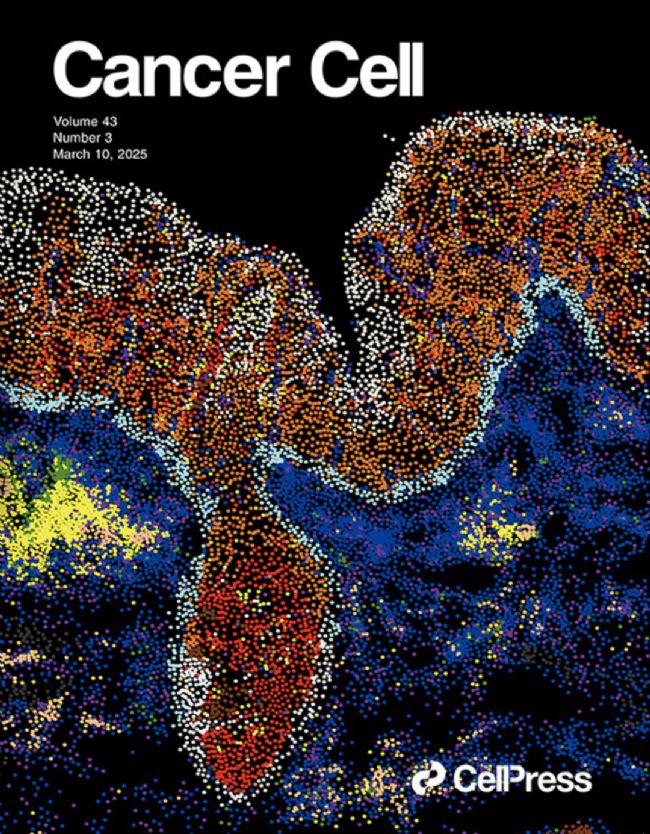
2025年3月10日,Cancer Cell以封面論文形式發(fā)表了題為 Single-cell Multi-stage Spatial Evolutional Map of Esophageal Carcinogenesis 的重要研究成果。研究團隊扎根河南林州食管癌醫(yī)院(原姚村衛(wèi)生院),通過長期跟蹤隨訪,獲得了大量珍貴的食管癌變?nèi)^程組織樣本。在此基礎(chǔ)上,團隊運用前沿的單細胞空間轉(zhuǎn)錄組技術(shù),成功繪制了全球首個單細胞分辨率的食管多階段癌變“時-空 ”動態(tài)演化圖譜,實現(xiàn)了對食管癌變?nèi)^程的系統(tǒng)性解析。研究突破傳統(tǒng)腫瘤線性演化理論的局限,創(chuàng)新性地提出“癌變空間演化”理論框架,首次揭示了腫瘤相關(guān)成纖維細胞(CAF)與侵襲性上皮細胞在癌前病變階段就可形成關(guān)鍵交互生態(tài)位(CAF-Epi niche)的腫瘤演化新機制。這一關(guān)鍵生態(tài)位可作為多種鱗狀細胞癌的癌前病變進展風(fēng)險預(yù)測的重要依據(jù),不僅為系統(tǒng)解析食管癌病因和演進機制奠定了重要理論基礎(chǔ),更為建立腫瘤早篩早診的“新林州模式”提供了科學(xué)依據(jù),對推動食管癌的早診早治具有重要的臨床實踐價值。
腫瘤的發(fā)生與發(fā)展是一個復(fù)雜的多階段過程,其中癌細胞與微環(huán)境細胞的空間互作和協(xié)同演化在癌變過程中起到關(guān)鍵作用。然而,現(xiàn)有研究手段和理論框架存在顯著局限性:單細胞測序技術(shù)雖能解析細胞異質(zhì)性,卻丟失了空間位置信息;傳統(tǒng)空間轉(zhuǎn)錄組技術(shù)受限于分辨率,難以在單細胞水平精準(zhǔn)解析腫瘤微環(huán)境。這些技術(shù)瓶頸嚴(yán)重制約了對腫瘤發(fā)生發(fā)展機制的深入理解,也阻礙了精準(zhǔn)診斷標(biāo)志物的發(fā)現(xiàn)和靶向干預(yù)策略的開發(fā)。
針對這一科學(xué)難題,研究團隊采用Xenium In Situ 和TF-seqFISH 兩種單細胞分辨率空間轉(zhuǎn)錄組學(xué)前沿技術(shù),對43名患者的127個食管癌變多階段組織樣本 進行深度解析,繪制了包含640萬個細胞的精準(zhǔn)癌變空間動態(tài)演化圖譜,首次在單細胞分辨率下系統(tǒng)揭示了食管癌變過程中特定細胞類型、基因表達譜及空間定位的協(xié)同演化規(guī)律,為理解食管癌的發(fā)生發(fā)展提供了創(chuàng)新性時空維度洞察。
研究發(fā)現(xiàn),食管癌的演進過程主要由一群具有高增殖表型的上皮細胞亞群驅(qū)動。在癌前病變早期,這些細胞向食管腔內(nèi)擴張并逐步擠占正常上皮細胞的生態(tài)位;隨著病變進展,它們進一步演化出去分化(dedifferentiation)和高侵襲性(invasive)表型,突破上皮-間質(zhì)屏障,誘導(dǎo)周圍正常成纖維細胞轉(zhuǎn)化為腫瘤相關(guān)成纖維細胞(CAF),并在浸潤前沿形成關(guān)鍵的CAF-Epi交互細胞生態(tài)位(CAF-Epi niche)。這一生態(tài)位通過驅(qū)動細胞外基質(zhì)(ECM)重塑,阻隔免疫細胞浸潤,同時促進 SPP1+巨噬細胞和Treg等免疫抑制性細胞的形成,進而加速了腫瘤的免疫逃逸進程。
通過系統(tǒng)的體外和體內(nèi)實驗,研究團隊揭示了CAF-Epi生態(tài)位形成的分子機制。研究發(fā)現(xiàn),上皮細胞中JAG1-NOTCH1信號軸的激活是生態(tài)位形成的關(guān)鍵驅(qū)動因素。該信號軸通過轉(zhuǎn)錄激活CXCL1/8,誘導(dǎo)正常成纖維細胞向CAF轉(zhuǎn)化;而激活的CAF又反過來促進上皮細胞的侵襲性表型,形成雙向協(xié)同演化機制。基于食管特異性敲除NOTCH1的轉(zhuǎn)基因小鼠模型,研究證實阻斷JAG1-NOTCH1信號通路可顯著抑制CAF-Epi生態(tài)位的形成,從而有效阻礙食管癌的進展。這一發(fā)現(xiàn)首次從空間維度系統(tǒng)揭示了食管癌變過程中細胞生態(tài)位的動態(tài)演化規(guī)律,不僅深化了對食管癌發(fā)生發(fā)展機制的認(rèn)識,更為靶向腫瘤生態(tài)位的精準(zhǔn)干預(yù)策略提供了重要的理論依據(jù)。
尤為重要的是,該研究實現(xiàn)了從基礎(chǔ)研究到臨床轉(zhuǎn)化的突破。研究團隊基于CAF-Epi生態(tài)位構(gòu)建了風(fēng)險評分模型,通過多中心、大樣本臨床隊列驗證,該模型不僅能夠顯著預(yù)測食管癌前病變的進展風(fēng)險,還在頭頸鱗癌、肺鱗癌、宮頸鱗癌等泛鱗癌患者中展現(xiàn)出卓越的疾病進展和預(yù)后預(yù)測效能。這一突破性成果證實CAF-Epi生態(tài)位可作為癌前病變進展的新型生物標(biāo)志物和預(yù)后評估工具,為腫瘤早診的臨床決策提供了有力支持,推動了腫瘤早診向更高維度發(fā)展,具有深遠的臨床轉(zhuǎn)化意義。
河南省林州市(原稱林縣)是我國食管癌的高發(fā)區(qū)。1959年起,遵照周恩來總理 “摸清情況,研究出對策” 的指示和總理的親切關(guān)懷下,中國醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院的醫(yī)生和科學(xué)家們組成北京醫(yī)療隊進駐林縣,建立了我國第一個腫瘤流行。
病學(xué)調(diào)查現(xiàn)場,開啟了大規(guī)模腫瘤流行病學(xué)研究的先河。66年來,幾代科學(xué)家秉承“牢記使命、不畏艱難、勇于探索、甘于奉獻”的北京醫(yī)療隊精神,經(jīng)過持續(xù)不懈探索,逐步構(gòu)建起獨具林縣特色的食管癌早診早治體系,為當(dāng)?shù)厥彻馨┌l(fā)病率的顯著下降作出了突出貢獻。然而,“林縣食管癌篩查模式”仍主要依賴傳統(tǒng)流行病學(xué)調(diào)查和有創(chuàng)的胃鏡檢查技術(shù),特別是對于處在癌前病變(高/低級別不典型增生)階段人群,腫瘤是否發(fā)生進展、病變復(fù)發(fā)風(fēng)險等關(guān)鍵科學(xué)問題仍缺乏系統(tǒng)的理論支撐,更缺乏快捷、無創(chuàng)的診治技術(shù)手段,這一瓶頸嚴(yán)重制約了林縣食管癌篩查模式的大規(guī)模推廣和應(yīng)用。本研究通過系統(tǒng)繪制食管癌變?nèi)皥D譜,揭示了CAF-Epi生態(tài)位在癌前病變風(fēng)險預(yù)測中具有重要價值。這一發(fā)現(xiàn)不僅為食管癌變機制提供了全新的理論框架,也為在全國推廣腫瘤早篩早診的“新林州模式”奠定了重要科學(xué)基礎(chǔ),為解決長期困擾我國食管癌篩查的技術(shù)瓶頸提供了關(guān)鍵依據(jù)。
中國醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院林東昕院士、吳晨教授(領(lǐng)銜通訊),華中科技大學(xué)公共衛(wèi)生學(xué)院常江教授(第一/并列通訊)領(lǐng)導(dǎo)該工作,北京師范大學(xué)王曉群教授,以及中國科學(xué)院上海營養(yǎng)與健康研究所Andrew Teschendorff教授為本研究的共同通訊作者,團隊成員具有不同的科學(xué)研究背景,形成了交叉互補優(yōu)勢,共同完成此項目。中國醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院盧俊廷博士、劉清怡博士、向濤博士和張少森副研究員為共同第一作者。王曉群團隊的劉澤源博士(昌平實驗室)與李馬宇卿(北師大博士生),食管癌變動態(tài)演變研究隊列的所有工作人員和參與者給予了支持。
原文鏈接:
https://doi.org/10.1016/j.ccell.2025.02.009
學(xué)術(shù)合作組織
(*排名不分先后)

戰(zhàn)略合作伙伴
(*排名不分先后)

轉(zhuǎn)載須知
【非原創(chuàng)文章】本文著作權(quán)歸文章作者所有,歡迎個人轉(zhuǎn)發(fā)分享,未經(jīng)作者的允許禁止轉(zhuǎn)載,作者擁有所有法定權(quán)利,違者必究。

- 單細胞空間轉(zhuǎn)錄組技術(shù)助力發(fā)現(xiàn)腫瘤癌前病變關(guān)鍵細胞生態(tài)位
- 染色質(zhì)開放性測序(ATAC-seq)原理以及應(yīng)用領(lǐng)域
- ATAC-seq開啟新視角:探索Shox2基因沙漠的神秘功能
- 揭秘TH17細胞分化“開關(guān)”:ChIP-seq 技術(shù)破解基因調(diào)控密碼
- DAP-seq技術(shù)助力揭秘葡萄耐冷性的糖代謝調(diào)控機制
- DAP-seq技術(shù)助力揭示擬南芥根基本組織發(fā)育的調(diào)控機制
- 客戶文章(Plant Com) DAP-seq助力揭示甘藍型油菜早花的遺傳機制
- 利用建庫篩選與單細胞測序技術(shù)對CAR信號模塊搭建進行研究





