研究案例:腸道微生物擾亂膽汁酸代謝或加重生酮飲食的肝臟負擔
人的身體就像一作精妙的工廠,食物是它的燃料。通常情況下,碳水化合物是身體的主要能量來源,當碳水不足時,身體就會啟動“備用模式”,燃燒脂肪產能, “生酮飲食(KD)”正是巧妙利用了這一機制,在這種高脂、低碳、適量蛋白的飲食模式下,機體會進入一種名為“酮癥”的狀態,肝臟將脂肪分解成酮體,其中最主要的就是β-羥基丁酸(BHB)。
生酮飲食在減肥和改善某些代謝紊亂方面確實有一定效果,但長期采用這種飲食模式,可能帶來胰島素抵抗和肝臟脂肪積累等副作用。因此,深入了解生酮飲食是如何調控身體代謝發揮作用的,這對我們更好地利用這種飲食方式、避免其潛在風險至關重要。
2025年4月,四川農業大學曹隨忠教授團隊等在Gut Microbes在線發表了題為“Gut microbiota regulates hepatic ketogenesis and lipid accumulation in ketogenic diet-induced hyperketonemia by disrupting bile acid metabolism”的研究文章,通過代謝組學、16S等技術方法,揭示了KD改變腸道微生物群落,促進C.perfringens(產氣莢膜梭菌)定植,增加肝臟BHB和TAG水平,干擾次級膽汁酸代謝,促使DCA向12-ketoLCA的轉化,顯著影響肝臟代謝,加劇肝臟脂肪積累和酮體生成,為理解生酮飲食的代謝效應提供了新的視角。(麥特繪譜提供膽汁酸譜定量檢測服務)

研究設計
動物模型:使用C57BL/6J小鼠,分為不同處理組
試驗1:抗生素(Abx)預處理后喂食KD或對照飲食,PND/PKD(PBS預處理正常飲食/生酮飲食);AND/AKD(抗生素處理正常飲食/生酮飲食)
試驗2:將高酮血癥奶牛糞便微生物移植(FMT)至小鼠,FMT-HE(健康奶牛糞菌移植);FMT-HYK(高酮血癥奶牛糞菌移植)
試驗3:通過口服干預產氣莢膜梭菌(C.perfringens),C.perfringens+KD/PBS+KD
技術方法:代謝組學、16S等
研究思路
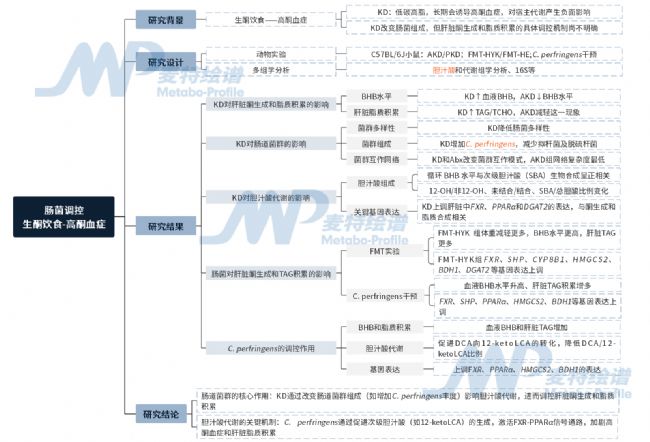
圖1. 技術路線圖
研究結果
1. KD增加循環BHB水平和肝臟TAG積累
生酮飲食顯著增加了小鼠血液中BHB的濃度,同時降低了血糖水平。AKD組小鼠在禁食后血糖水平顯著高于PKD組。同時,生酮飲食還顯著增加了肝臟中TAG的積累,而血清中TAG水平在AKD組中有所降低,提示生酮飲食可能主要促進肝臟脂肪合成和積累,而非促進脂肪從外周組織向肝臟的運輸。此外,生酮飲食還導致血清和肝臟中總膽固醇(TCHO)水平顯著升高。
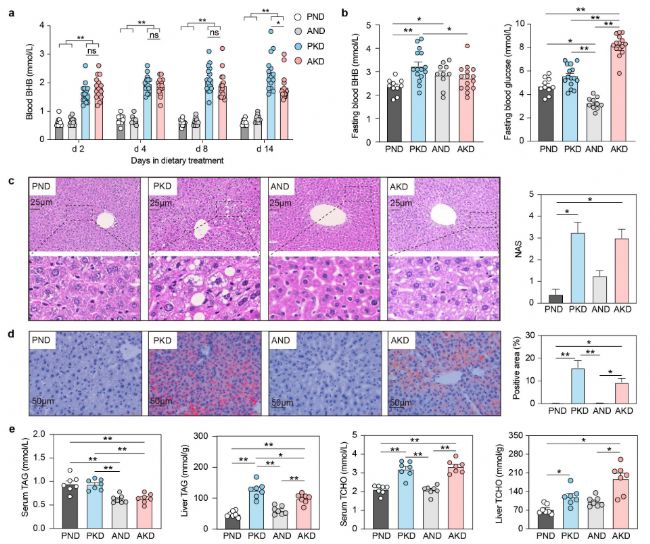
圖2. 生酮飲食增強小鼠生酮和TAG蓄積
2. 生酮飲食影響腸道微生物群落的組成和相互作用
生酮飲食降低了腸道菌群的α多樣性,且AKD組的多樣性最低,表明生酮飲食可能抑制了腸道菌群的恢復和重建。在菌群結構方面,生酮飲食顯著改變了腸道菌群的組成,特別是在門水平上。通過共現網絡分析發現,生酮飲食組的腸道菌群網絡復雜性降低,節點和邊的數量減少,表明生酮飲食可能削弱了腸道菌群之間的相互作用和協同性。
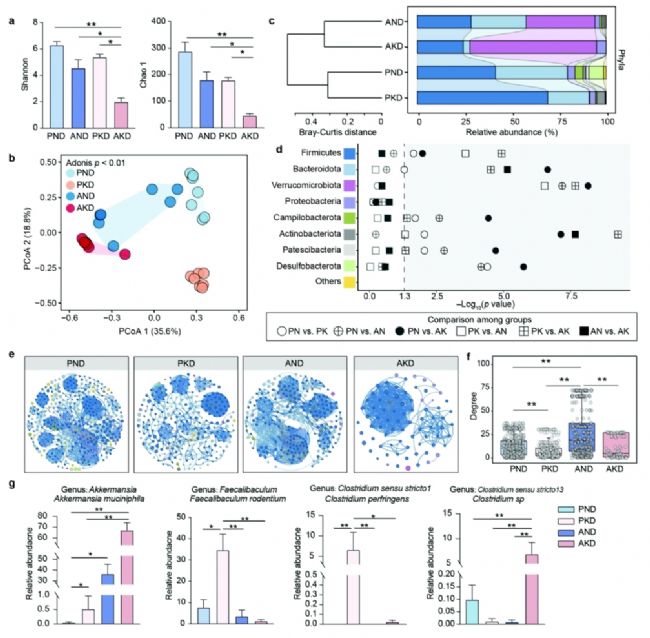
圖3.生酮飲食破壞腸道微生物群重塑
3. 生酮飲食通過操縱腸道微生物功能影響膽汁酸代謝
進一步研究KD消耗期間腸道菌群與糖脂代謝之間的關系,分析了12條KEGG三級代謝通路,發現血液中BHB水平與次級膽汁酸(SBA)合成呈顯著正相關。在喂食KD的小鼠中,12-羥基膽汁酸與非12-羥基膽汁酸的比值增加,而AKD組中游離膽汁酸與結合膽汁酸的比值以及SBA與總膽汁酸的比值最低。特定膽汁酸如TCA和TCDCA在PKD和AKD組中水平較高,而部分SBA(如TωMCA、ωMCA、THDCA和TDCA)在AKD組中水平較低。肝臟中與膽汁酸代謝相關的基因表達也發生變化,如CYP27A1在PKD組中表達下調,CYP8B1表達上調。此外,PKD組中FXR、HMGCS2、BDH1、DGAT2等基因表達水平顯著高于AKD組,表明腸道菌群可能通過調節膽汁酸代謝影響肝臟的酮生成和脂肪合成。
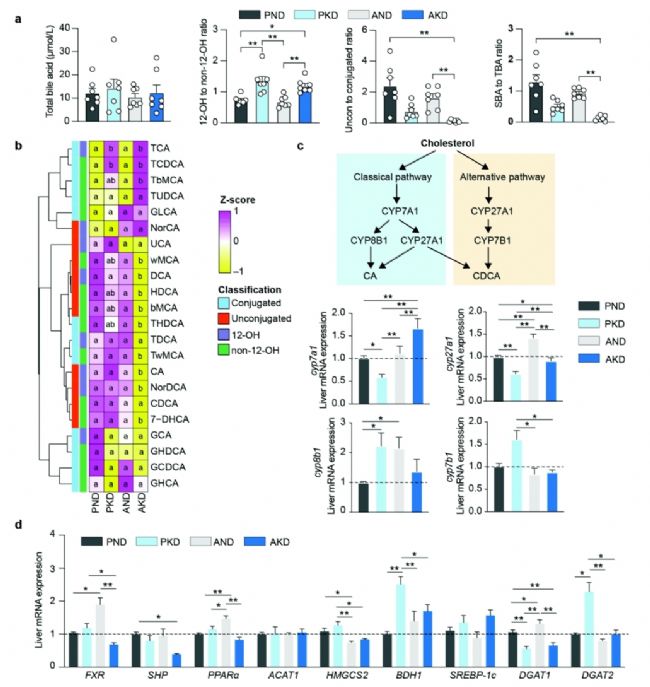
圖4. 腸道菌群對膽汁酸代謝和生酮的影響
4. 腸道微生物對肝臟酮生成和TAG積累的影響
通過糞菌移植(FMT)探討腸道菌群與酮生成的因果關系。結果顯示,FMT-HYK組在長期禁食后體重下降更多,血液中BHB水平更高。經過兩周生酮飲食干預后,FMT-HYK組的HOMA-IR(胰島素抵抗的穩態模型評估)更高,肝臟TAG積累更多,且HDCA、βUDCA和7-ketoLCA等膽汁酸水平顯著上升。此外,FMT-HYK組中FXR、SHP、CYP8B1、HMGCS2、BDH1和DGAT2等基因表達上調,進一步表明腸道菌群可能通過調節膽汁酸代謝和相關基因表達影響酮生成和脂肪積累。此外,FMT-HYK組中Clostridium perfringens等菌種相對豐度顯著更高,并且與血液中BHB水平及肝臟TAG積累呈強正相關,提示這些菌種可能在增強酮生成和脂肪積累中起關鍵作用。
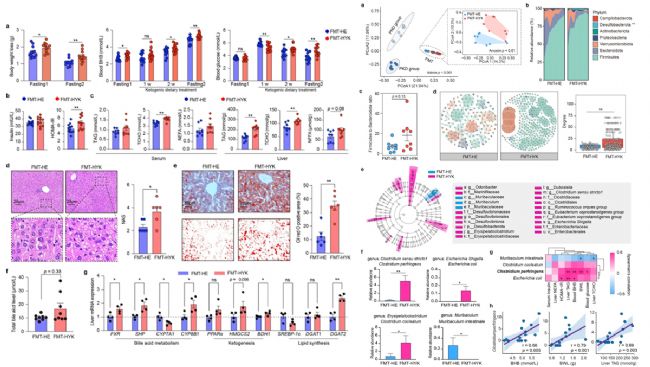
圖5. 高酮血癥奶牛供體FMT后小鼠腸道微生物組成及代謝變化
5. C.perfringens對肝臟酮生成和TAG積累的影響
在生酮飲食(KD)喂養的小鼠中進行的干預試驗表明,C.perfringens干預并未顯著影響體重,但顯著提高了血液中BHB水平,并加劇了肝臟三酰甘油(TAG)的積累。此外,C.perfringens干預顯著上調了FXR、SHP、PPARα、HMGCS2、BDH1等基因的表達,同時在甘油磷酸介導的TAG合成途徑中,AGPAT1、AGPAT2、DGAT1、DGAT2的mRNA水平也顯著上調,表明C.perfringens可能通過調節這些基因影響肝臟的酮生成和脂肪合成。
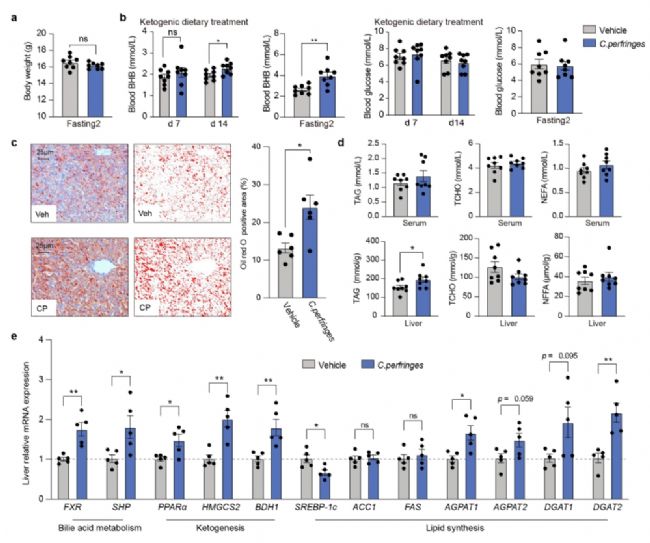
圖6. 產氣莢膜梭菌對肝臟生酮和脂質蓄積的影響
6. C.perfringens對次級膽汁酸代謝的影響
在肝臟中,C.perfringens組的甘膽酸(GCA)、牛磺膽酸(TCA)等膽汁酸水平顯著升高,而在結腸中,12-酮脫氧膽酸(12-ketoLCA)、7-酮脫氧膽酸(7-ketoLCA)等次級膽汁酸水平顯著增加。這些次級膽汁酸水平與血液和肝臟中的β-羥基丁酸(BHB)水平呈正相關。此外,C.perfringens組的脫氧膽酸(DCA)與12-ketoLCA比值顯著降低,且這一比值的降低與BHB水平的升高呈負相關,提示C.perfringens可能通過干擾膽汁酸代謝影響酮生成。
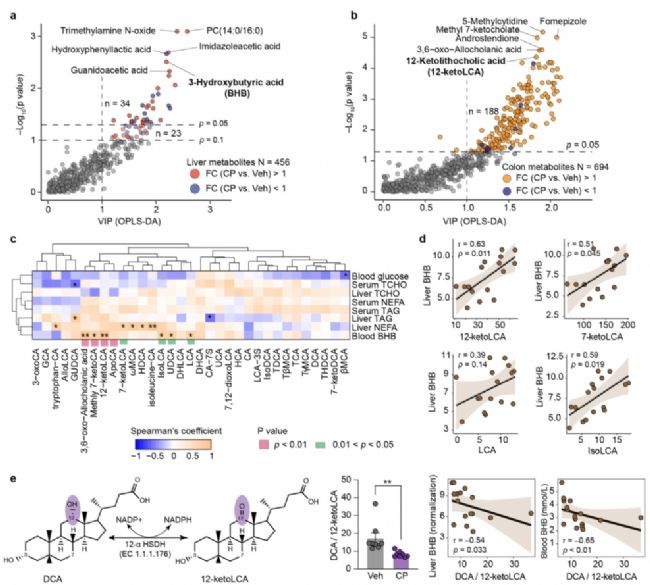
圖7. 產氣莢膜梭菌促進次級膽汁酸代謝
研究結論
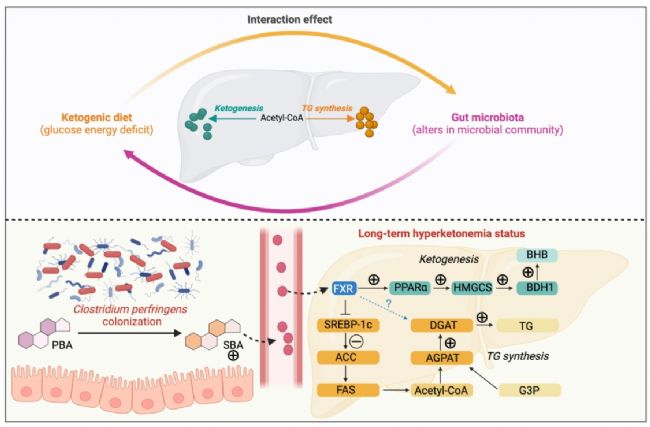
KD通過改變腸道菌群組成(如增加C.perfringens豐度)影響膽汁酸代謝,進而調控肝臟酮生成和脂質積累。C.perfringens通過促進次級膽汁酸(如12-ketoLCA)的生成,激活FXR-PPARα信號通路,加劇高酮血癥和肝臟脂質積累。
參考文獻
Gut microbiota regulates hepatic ketogenesis and lipid accumulation in ketogenic diet-induced hyperketonemia by disrupting bile acid metabolism. Gut Microbes. 2025
繪譜幫你測
膽汁酸是膽汁的重要組成部分,由肝細胞代謝產生,進入腸道由菌群進行代謝和修飾,之后部分通過腸肝循環反作用于肝臟。因此,膽汁酸水平異常可能與肝臟疾病有關,如肝硬化、脂肪肝、急慢性肝炎、肝癌等。此外,其他器官疾病也導致肝細胞功能受損,膽汁代謝出現異常,從而出現膽汁酸水平升高,例如膽囊疾病、腸道疾病。探討膽汁酸水平異常與上述等疾病的關系,有助于為疾病的診斷和治療提供新的思路和方法。
麥特繪譜公司的經典膽汁酸產品已協助數千家合作單位開展肝病、腸病、心血管疾病、糖尿病、肥胖、衰老、腫瘤/癌癥、畜牧動物、中藥等領域功能研究,已發表項目文章100+篇,其中大于10分的50+篇,涵蓋Cell Metabolism, Nature Metabolism, Nature Communications, Nature Aging, Advanced Science, Microbiome, Science Advances等期刊。近期公司全新升級的近300種膽汁酸旗艦版,通過高精度、高靈敏度的檢測技術,實現了對膽汁酸譜更加全面的定量檢測分析,提升臨床研究和疾病診斷的深度和廣度。不僅涵蓋傳統的初級和次級膽汁酸類型,更在此基礎上大幅度擴展,新增了多種復雜結合型的膽汁酸,包括氨基酸結合型膽汁酸、多胺結合型膽汁酸、酰基結合型膽汁酸、脂肪酸結合型膽汁酸等,為深入探索膽汁酸在人體健康與疾病中的復雜作用機制提供了強有力的工具。





