抗體偶聯藥物(ADC)藥物有效載荷的作用機制及在癌癥治療中的應用前景
在癌癥治療的"軍備競賽"中,抗體偶聯藥物(ADC)正以前所未有的精準性和殺傷力改寫戰場規則。目前已有十幾種ADC藥物獲批上市,數百項臨床試驗正如火如荼,探索新靶點和適應癥。這場革命的背后,是四大核心技術突破:靶點驗證、抗體優化、偶聯升級、載荷創新。其中,有效載荷的多樣性更是ADC未來進化的關鍵引擎。
一、載荷進化論:從"單一彈頭"到"超級武器庫"
傳統ADC的載荷如同"單一彈頭":微管抑制劑(如MMAE)和DNA烷化劑(如卡奇霉素)占據主導地位。但近年來,拓撲異構酶1抑制劑的崛起打破了這一格局。Enhertu®(DS-8201a)和Trodelvy®(IMMU-132)的成功,證明非傳統載荷的潛力。這些創新得益于連接子技術的突破,允許更高的藥物-抗體比(DAR)、更穩定的載荷附著,以及更強的"旁觀者效應"。
l 鵝膏覃堿(Amanitin)家族是天然的RNA聚合酶II抑制劑,能阻斷轉錄過程。盡管毒性劇烈,但作為ADC載荷展現出獨特優勢:
四、Bcl-xL抑制劑:凋亡天平的"砝碼調控者"
Bcl-xL蛋白是癌細胞的"存活開關",抑制劑通過打破促凋亡/抗凋亡平衡觸發細胞死亡:
ABBV-155:B7-H3抗體與Bcl-xL抑制劑偶聯,在肺癌和乳腺癌中展現安全性與療效。
五、免疫刺激載荷:喚醒免疫系統的"警報器"
免疫檢查點抑制劑的成功啟發了新方向:將STING/TLR激動劑與抗體結合,在腫瘤微環境精準釋放,激活先天免疫:
NJH395/BDC1001:代表新一代免疫刺激ADC,有望突破全身毒性限制。
六、未來戰場:載荷創新的"無限可能"
ADC的載荷庫正在向更廣闊領域延伸:
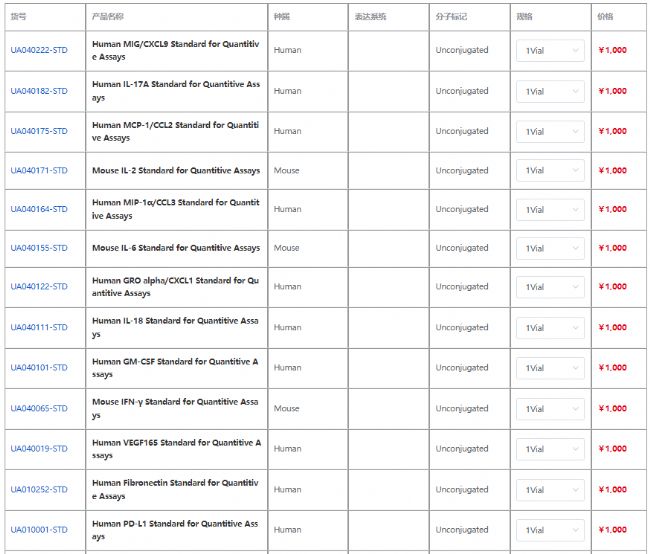
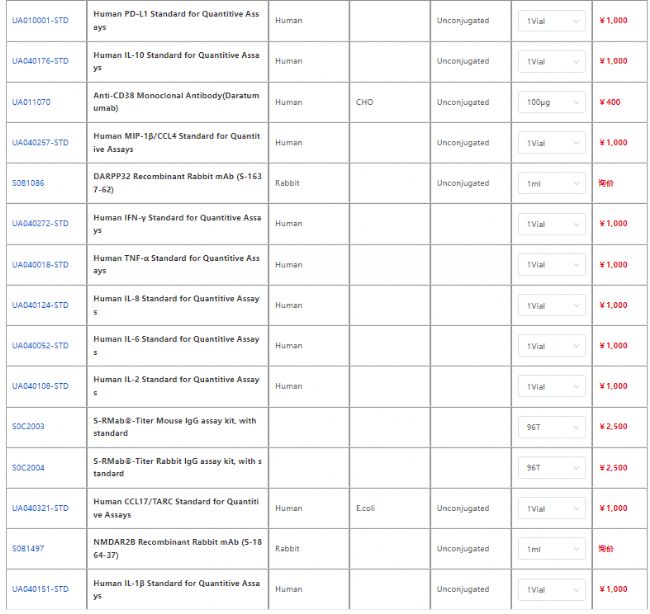
杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。
一、載荷進化論:從"單一彈頭"到"超級武器庫"
傳統ADC的載荷如同"單一彈頭":微管抑制劑(如MMAE)和DNA烷化劑(如卡奇霉素)占據主導地位。但近年來,拓撲異構酶1抑制劑的崛起打破了這一格局。Enhertu®(DS-8201a)和Trodelvy®(IMMU-132)的成功,證明非傳統載荷的潛力。這些創新得益于連接子技術的突破,允許更高的藥物-抗體比(DAR)、更穩定的載荷附著,以及更強的"旁觀者效應"。
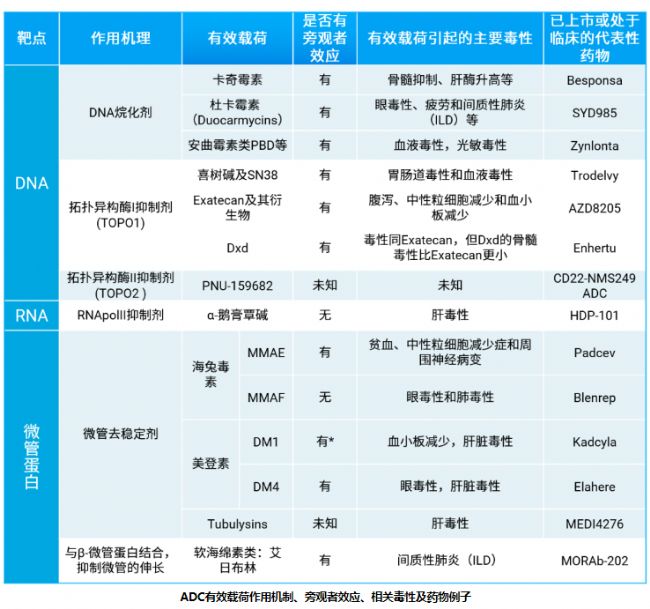
ADC有效載荷作用機制、旁觀者效應、相關毒性及藥物例子
二、拓撲異構酶抑制劑:DNA修復工地的"破壞者"
拓撲異構酶是控制DNA超螺旋結構的"維修工",抑制劑則通過阻斷其修復機制引發DNA斷裂,最終誘導癌細胞凋亡。盡管拓撲異構酶抑制劑的效力比微管抑制劑低百倍,但ADC結構改良解決了這一問題:
喜樹堿(CPT)家族
- Enhertu®:搭載DXd(exatecan衍生物),DAR高達8,骨髓毒性顯著降低。
- PRO1184/PRO1160:采用親水連接子,突破疏水性限制,增強旁觀者效應。
- AZD8205:特有exatecan衍生物AZ'0132,靶向B7-H4,展現廣譜潛力。
- 伊立替康(Irinotecan)家族
- Trodelvy®:SN-38與TROP2抗體偶聯,獲批治療三陰性乳腺癌。
- IMMU-130/140:分別靶向CEACAM5和HLA-DR,拓展適應癥邊界。

拓撲異構酶2抑制劑示意圖
l 鵝膏覃堿(Amanitin)家族是天然的RNA聚合酶II抑制劑,能阻斷轉錄過程。盡管毒性劇烈,但作為ADC載荷展現出獨特優勢:
- HDP-101:靶向BCMA的ADC,誘導免疫原性細胞死亡,與免疫檢查點抑制劑協同增效。
- 其他探索:雷公藤甲素、HDAC抑制劑等轉錄調控分子,正在突破溶解度與毒性瓶頸。
四、Bcl-xL抑制劑:凋亡天平的"砝碼調控者"
Bcl-xL蛋白是癌細胞的"存活開關",抑制劑通過打破促凋亡/抗凋亡平衡觸發細胞死亡:
ABBV-155:B7-H3抗體與Bcl-xL抑制劑偶聯,在肺癌和乳腺癌中展現安全性與療效。
五、免疫刺激載荷:喚醒免疫系統的"警報器"
免疫檢查點抑制劑的成功啟發了新方向:將STING/TLR激動劑與抗體結合,在腫瘤微環境精準釋放,激活先天免疫:
NJH395/BDC1001:代表新一代免疫刺激ADC,有望突破全身毒性限制。
六、未來戰場:載荷創新的"無限可能"
ADC的載荷庫正在向更廣闊領域延伸:
- 拓撲異構酶2抑制劑:如PNU-159682,突破外排轉運限制。
- 激酶抑制劑:木黃酮偶聯物展現多靶點潛力。
- 雙彈頭設計:核素+細胞毒素、PROTAC技術等跨界組合。
結語:當"魔法子彈"裝上"智能彈頭"
ADC藥物的未來,屬于那些敢于突破傳統、擁抱創新的探索者。從拓撲異構酶抑制劑到RNA聚合酶抑制劑,從免疫刺激載荷到雙彈頭設計,每一類新型載荷都在拓展ADC的適應癥邊界。隨著技術迭代,ADC或將真正成為終結癌癥的"終極武器"——精準制導、智能殺傷、喚醒免疫,為人類開啟癌癥治療的新紀元。


杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





